|
|
| NG2胶质细胞是大脑免疫稳态失衡的“刹车” | BMC Medicine |
|
论文标题:NG2 glia regulate brain innate immunity via TGF-β2/TGFBR2 axis
期刊:BMC Medicine
作者:Shu-zhen Zhang, Qin-qin Wang et al
发表时间:2019/11/15
DOI:10.1186/s12916-019-1439-x
微信链接:点击此处阅读微信文章
中科院脑科学与智能技术卓越创新中心(神经科学研究所)神经科学国家重点实验室周嘉伟研究团队于2019月11日在BMC Medicine期刊在线发表了题为NG2 glia regulate brain innate immunity via TGF-β2/TGFBR2 axis的研究论文。该研究深入探讨了神经免疫学的一个关键科学问题,即大脑的固有免疫是如何调控的。
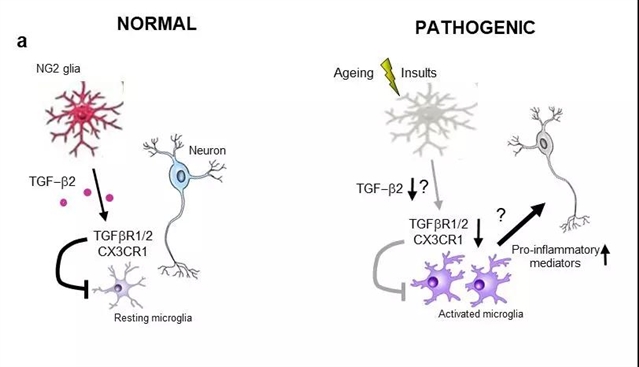
NG2胶质细胞通过TGF-β2/TGFBR2通路调控脑内固有免疫
大脑的固有免疫对维持大脑的正常功能至关重要。已知包括神经元、小胶质细胞和星形胶质细胞在内的多种类型的细胞在脑内组成一个复杂而严密的体系,共同维护大脑免疫稳态,确保侵入大脑的病原体或内生的异常蛋白和细胞被及时清除。小胶质细胞在此过程中发挥重要作用。它们首先感知病理刺激,并迅速通过吞噬作用和产生各种炎症介质来响应这些刺激,以达到清除病原体、异常蛋白和细胞的作用。但是这些炎症反应缺乏选择性,在维护大脑稳定的同时,不可避免地对自身正常组织造成损害。正常情况下,炎症反应逐渐消失,机体内启动炎症修复机制,但在脑老化和一些疾病状态,炎症修复机制发生不同程度的障碍,进而促进了慢性迁延性炎症反应的发生和发展。近年来,越来越多的证据显示,脑内免疫系统的失衡在多种神经系统疾病如帕金森病、阿尔茨海默病等的发病机制中发挥重要的作用。因此,解析脑内固有免疫调节的细胞和分子机制对于深入了解大脑工作原理和神经系统疾病发病机制有重要意义。
NG2胶质细胞是脑内除星形胶质细胞、小胶质细胞和少突胶质细胞外的第四种胶质细胞。长期以来,NG2胶质细胞被认为是少突胶质细胞的前体细胞。近年的研究表明,它们也参与代谢和情绪调控中。然而,NG2胶质细胞在大脑神经免疫中的确切作用和机制尚不清楚。周嘉伟研究团队成员张淑贞、王琴琴博士等首先利用白喉毒素/白喉毒素受体系统,特异地删除NG2胶质细胞。在细菌脂多糖(Lipopolysaccharide, LPS)诱导的炎症模型中,NG2细胞删除的小鼠脑内促炎症因子表达水平显著升高,小胶质细胞激活程度比单纯LPS所引起的更为剧烈,表明NG2胶质细胞在脑内具有抑制炎症的功能。这一炎症状态与维持小胶质细胞稳态相关基因的显著下调有直接关系,可见NG2胶质细胞对于维持脑内小胶质细胞稳态至关重要。
进一步研究发现,NG2胶质细胞来源的TGF-β2能够通过小胶质细胞表达的TGFBR2受体显著降低LPS引起的小胶质细胞的过度激活。增强TGF-β2/TGFBR2通路活性可明显降低LPS引起的脑内炎症反应,而阻断该信号通路则可显著增强LPS引起的炎症水平,这一作用是由小胶质细胞稳态维持关键基因所介导的。因此,TGF-β2/TGFBR2通路在NG2胶质细胞介导的免疫抑制作用中起着不可或缺的作用。
帕金森病的病理变化之一是大脑多个脑区小胶质细胞的激活和炎症因子水平的上升,但确切原因尚未完成阐明。该研究团队还发现,帕金森病患者黑质区域NG2胶质细胞的标志物表达水平下降。在帕金森病动物模型中,删除NG2胶质细胞能显著增加多巴胺神经元的死亡及小胶质细胞的激活程度,表明在帕金森病发病过程中,NG2胶质细胞肯发挥重要的抑制小胶质细胞激活的作用。这些发现为今后建立基于NG2胶质细胞的抑制神经炎症进而缓解PD发生发展的方法有重要的理论意义。
该研究获得上海市重大科技专项、国家自然科学基金等项目的支持。
摘要:
Background
Brain innate immunity is vital for maintaining normal brain functions. Immune homeostatic imbalances play pivotal roles in the pathogenesis of neurological diseases including Parkinson’s disease (PD). However, the molecular and cellular mechanisms underlying the regulation of brain innate immunity and their significance in PD pathogenesis are still largely unknown.
Methods
Cre-inducible diphtheria toxin receptor (iDTR) and diphtheria toxin-mediated cell ablation was performed to investigate the impact of neuron-glial antigen 2 (NG2) glia on the brain innate immunity. RNA sequencing analysis was carried out to identify differentially expressed genes in mouse brain with ablated NG2 glia and lipopolysaccharide (LPS) challenge. Neurotoxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-treated mice were used to evaluate neuroinflammatory response in the presence or absence of NG2 glia. The survival of dopaminergic neurons or glial cell activation was evaluated by immunohistochemistry. Co-cultures of NG2 glia and microglia were used to examine the influence of NG2 glia to microglial activation.
Results
We show that NG2 glia are required for the maintenance of immune homeostasis in the brain via transforming growth factor-β2 (TGF-β2)-TGF-β type II receptor (TGFBR2)-CX3C chemokine receptor 1 (CX3CR1) signaling, which suppresses the activation of microglia. We demonstrate that mice with ablated NG2 glia display a profound downregulation of the expression of microglia-specific signature genes and remarkable inflammatory response in the brain following exposure to endotoxin lipopolysaccharides. Gain- or loss-of-function studies show that NG2 glia-derived TGF-β2 and its receptor TGFBR2 in microglia are key regulators of the CX3CR1-modulated immune response. Furthermore, deficiency of NG2 glia contributes to neuroinflammation and nigral dopaminergic neuron loss in MPTP-induced mouse PD model.
Conclusions
These findings suggest that NG2 glia play a critical role in modulation of neuroinflammation and provide a compelling rationale for the development of new therapeutics for neurological disorders.
(来源:科学网)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。