论文标题:Memory formation and long-term maintenance of IL-7Rα+ ILC1s via a lymph node-liver axis
期刊:Nature Communications
作者:Xianwei Wang, Hui Peng, Jingjing Cong, Xuefu Wang, Zhexiong Lian, Haiming Wei, Rui Sun, Zhigang Tian
发表时间:2018/11/19
数字识别码: 10.1038/s41467-018-07405-5
原文链接:http://t.cn/EL8n6q4
微信链接:https://mp.weixin.qq.com/s/3rIGbq-v5fzzCMKzbY1QiQ
2018年11月19日,《自然-通讯》在线发表了中国科学技术大学
与医学部、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心田志刚、孙汭教授课题组的研究论文“Memory formation and long-term maintenance of IL-7Rα+ ILC1s via a lymph node-liver axis”,该研究发现ILC1s具有免疫记忆功能,并揭示了其记忆形成及维持机制。
固有淋巴细胞(innate lymphoid cells,ILCs)是固有免疫系统的重要组成部分,在机体抵抗病毒、细菌、寄生虫等病原体感染的免疫应答早期起到关键作用。近年来,越来越多的证据表明ILCs也具有适应性免疫系统的功能-免疫记忆,它们能够对半抗原、MCMV病毒、细胞因子刺激等产生记忆,介导长期的适应性免疫应答。2013年,田志刚教授课题组在国际上首次发现了CD49a+肝脏驻留NK细胞(liver-resident NK, LrNK),并揭示了LrNK细胞的免疫记忆功能(J Clin Invest123, 1444-1456 (2013),之后该细胞被免疫学界列为三大类ILC细胞之一的ILC1。然而,LrNK或ILC1细胞如何应答特异性抗原及如何获得免疫记忆功能仍是未解之谜。
利用接触性超敏反应模型,课题组发现半抗原致敏能够将IL-7Rα+ ILC1s招募至皮肤引流淋巴结,该过程依赖趋化因子受体CXCR3。进入引流淋巴结后,ILC1s迅速应答半抗原,分泌大量IFN-γ和TNF,表现出活化的状态。致敏后48小时,淋巴结ILC1s数量达到峰值;72小时,淋巴结ILC1s获得对特定半抗原的免疫记忆潜能。随后,记忆性ILC1s依赖S1PR1迁出引流淋巴结;通过其表面的CXCR6与肝窦中丰富的CXCL16相互作用,记忆性ILC1s得以驻留在肝脏中。此外,肝窦中的IL-7对于记忆性ILC1s的长期存活具有重要作用。当机体再次遭遇特定抗原时,肝脏驻留的记忆性IL-7Rα+ ILC1s能够迁移到效应部位,介导皮肤局部的炎症反应。综上,该研究鉴定了一群具有免疫记忆功能的ILC1s亚群,记忆性ILC1s在淋巴结中形成,而在肝脏中长期驻留。这项工作对于“ILC Memory”这一新兴领域的研究提供了新的视角。
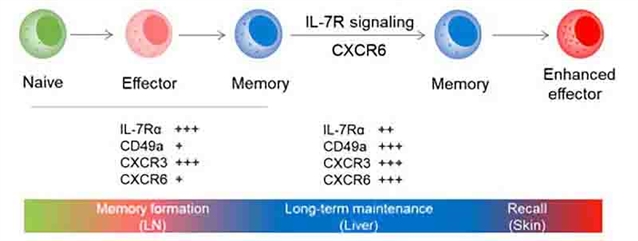
图1:记忆性IL-7Rα+ ILC1s形成过程图
该研究工作得到了国家自然科学基金的资助。通讯作者为中国科大田志刚、孙汭教授及彭慧副教授,第一作者为中国科大王宪伟博士。
(
与医学部、中科院天然免疫与慢性疾病重点实验室、合肥微尺度物质科学国家研究中心分子医学研究部、科研部)
摘要:Natural killer (NK) cells are reported to have immunological memory, with CD49a+ liver-resident NK cells shown to confer hapten-specific memory responses, but how this memory is induced or maintained is unclear. Here we show that memory type I innate lymphoid cells (ILC1s), which express IL-7Rα, are generated in the lymph nodes (LNs) and require IL-7R signaling to maintain their longevity in the liver. Hapten sensitization initiates CXCR3-dependent recruitment of IL-7Rα+ ILC1s into skin-draining LNs, where they are primed and acquire hapten-specific memory potential. Memory IL-7Rα+ ILC1s then exit draining LNs and are preferentially recruited, via CXCR6, to reside in the liver. Moreover, long-term blockade of IL-7R signaling significantly reduces ILC1-mediated memory responses. Thus, our results identify a memory IL-7Rα+ ILC1 population and reveal a LN-liver axis that is essential for ILC1 memory generation and long-term maintenance.
阅读论文全文请访问:http://t.cn/EL8n6q4
期刊介绍:Nature Communications (https://www.nature.com/ncomms/) is an open access journal that publishes high-quality research from all areas of the natural sciences. Papers published by the journal represent important advances of significance to specialists within each field.
The 2017 journal metrics for Nature Communications are as follows:
•2-year impact factor: 12.353
•5-year impact factor: 13.691
•Immediacy index: 1.829
•Eigenfactor® score: 0.92656
•Article Influence Score: 5.684
•2-year Median: 8
来源:科学网
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。