武汉病毒所揭示乙型脑炎病毒入侵机制
中国科学院武汉病毒研究所研究员肖庚富领导的科研团队在乙型脑炎病毒(Japanese encephalitis virus,JEV)囊膜蛋白介导病毒入侵宿主细胞分子机制研究方面取得新进展,相关研究结果Structure-based mutational analysis of several sites in the E protein: Implications for understanding the entry mechanism of Japanese encephalitis virus 近日在病毒学期刊Journal of virology 上在线发表。
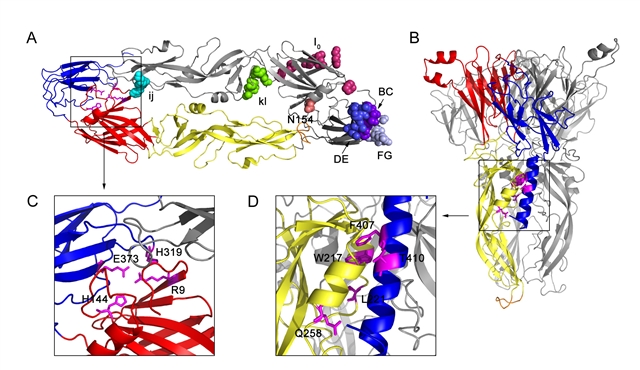
乙脑病毒是和黄热病毒、登革热病毒、西尼罗病毒同一属的虫媒黄病毒,可感染蚊子、鸟、猪,人为其终末宿主,并引起病毒性脑炎。乙脑病毒已经从日本等亚洲地区传播到澳大利亚约克角半岛,给世界公共卫生安全带来日趋严重的威胁。乙脑病毒表面的囊膜蛋白E介导病毒入侵宿主细胞,包括病毒与细胞受体结合、受体介导内吞、低pH诱导病毒膜与胞内体膜的融合过程。
论文第一作者、助理研究员刘海滨等系统地分析了乙脑病毒囊膜蛋白的结构,认为16个关键氨基酸位点或区段对病毒入侵可能至关重要,利用定点突变技术将16个突变引入E基因,并通过反向遗传操作系统构建一系列E蛋白单点突变或区段缺失的重组病毒。他们意外地发现,10个突变不能有效地产生子代病毒颗粒,其中5个突变R9A和I0、ij、 BC、FG 破坏了病毒颗粒的包装,另外5个突变E373A、F407A、L221S、W217A和kl阻滞了病毒颗粒的释放。随后,他们以野生型病毒为对照,重点检测能够生产感染性颗粒的6种突变病毒株的进入活性。实验发现以往被普遍认为是受体结合域的糖基化位点N154和DE loop并不是乙脑病毒进入哺乳动物细胞BHK-21的关键位点,其突变对病毒入侵没有显著性影响。H144和H319两个正电氨基酸参与囊膜蛋白“盐桥”的形成,T410 和 Q258 则参与病毒-细胞膜融合“拉链”的形成,这4个位点中任一位点的单点突变都会抑制病毒-细胞膜融合。最后,连续传代几个突变病毒株并进行测序分析发现:大部分适应性突变发生在囊膜蛋白表面,主要是由负电氨基酸突变为正电或不带电荷的氨基酸,某些适应性突变能够很好地恢复前述定点突变病毒株的入侵活性。
论文共同作者之一、黄病毒专家张波认为,此项研究揭示了乙脑病毒囊膜蛋白关键位点在病毒组装、释放和进入过程中的作用,为进一步理解其它黄病毒的入侵机制做出了贡献。从遗传进化上看,黄病毒科病毒的囊膜蛋白均高度保守,入侵活性致弱的乙脑病毒囊膜蛋白突变株H144A、H319A、T410A和Q258A可为其它黄病毒减毒活疫苗的研究与开发提供重要的借鉴。
该研究得到了纳米研究国家重大科学研究计划和国家自然科学基金青年项目的资助。(来源:中国科学院武汉病毒研究所)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。