2022年5月26日,南方科技大学刘心元教授团队与浙江大学洪鑫教授团队合作,在Nature Chemistry上发表了一篇新研究论文,题为“Mechanism-based ligand design for copper-catalysed enantioconvergent C(sp3)–C(sp) cross-coupling of tertiary electrophiles with alkynes”。
课题组成功实现了外消旋非环状三级烷基卤代烃与末端炔烃的立体汇聚式不对称交叉偶联反应,直接高效、高对映选择性地构建了一系列含有非环状手性季碳中心的化合物。
交叉偶联反应是构建碳–碳键的最高效的方法之一, 2010年诺贝尔化学奖即授予了在该领域做出杰出贡献的三位科学家。近年来,随着不对称催化和3d过渡金属催化的发展,卤代烷烃参与的C(sp3)–C(sp)交叉偶联反应,尤其是更具挑战的不对称交叉偶联逐渐成为化学家们关注的一个热点。然而到目前为止,通过三级卤代烷烃的立体汇聚式交叉偶联反应构建非环状季碳手性中心的报道还比较稀少。
Sonogashira偶联是构建炔类化合物的一个重要的方法。2019年,刘心元教授团队成功开发了一价铜与手性三齿阴离子N,N,P-配体组成的单电子催化体系,通过有效调控铜的还原性和立体环境,实现了外消旋二级卤代烷烃和端炔的不对称Sonogashira交叉偶联反应(Nat. Chem.2019, 11,1158)。
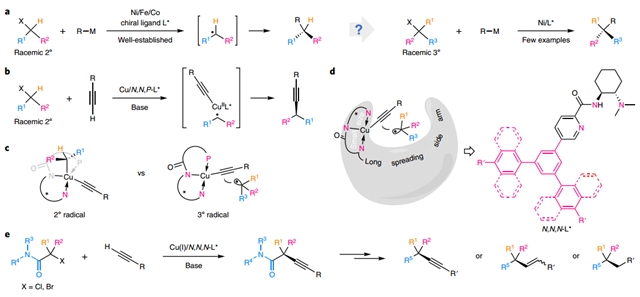
近期,团队与浙江大学洪鑫教授团队合作,基于理论计算和手性配体设计,发展了带有小位阻配位中心、长边臂效应的手性三齿阴离子N,N,N-配体,解决了三级烷基自由基的手性控制难题,成功实现了外消旋非环状三级烷基卤代烃与末端炔烃的立体汇聚式不对称交叉偶联反应,直接高效、高对映选择性地构建了一系列含有非环状手性季碳中心的化合物。机理研究和DFT计算表明,和二级自由基参与的交叉偶联反应明显不同,三级烷基自由基采取自由基取代的方式直接形成C–C键。
这类N,N,N-配体的成功开发为发展铜催化的三级烷基自由基参与的手性季碳中心的不对称合成提供了一个切实可行的新策略。该方法能实现多样化的后转化过程并为快速构建C(sp3)–C(sp)/C(sp2)/C(sp3)化学键提供了有效的平台,充分说明了方法的实用性。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-022-00954-9