|
|
| N-杂芳环与炔烃的对映选择性极性反转去芳构化[3+2]环化反应 |
|
近日,浙江工业大学贾义霞团队利用手性Co催化剂,在还原剂In或Zn粉条件下,实现了缺电性N-杂芳烃(喹啉、异喹啉、吡啶、喹喔啉)和富电性N-H吲哚与烷基取代炔烃的对映选择性去芳构化[3+2]极性反转螺环化反应。
2022年1月10日,该研究结果以“Enantioselective Dearomative [3 + 2] Umpolung Annulation of N-Heteroarenes with Alkynes”为题发表在J. Am. Chem. Soc.上。论文主要作者为博士研究生杨鹏和王强等。
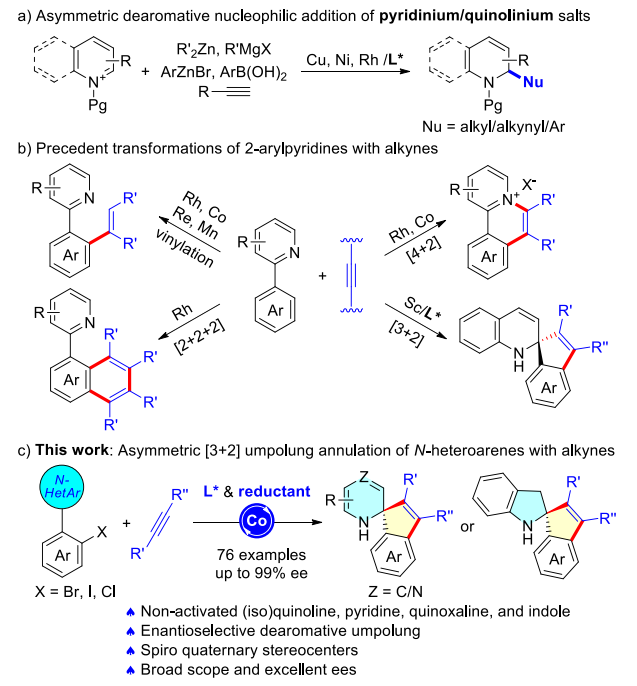
含氮脂肪环,如氢化吡啶、氢化喹啉和氢化异喹啉等,是天然产物、药物和生物活性分子的常见结构单元。过渡金属催化缺电子N-杂芳环的对映选择性去芳构化反应是合成这些分子的可靠方法之一。通过对活性吡啶或喹啉盐的亲核加成,已经实现了一系列过渡金属催化的不对称反应,如1)与有机锌、格氏试剂或末端炔在铜催化下的去芳构化烷基化和炔基化反应;2)与芳基锌试剂在镍催化下的芳基化反应;3)与有机硼试剂在铑催化下的不对称芳基化反应等。尽管如此,非活化N-杂芳环很少应用于金属催化的不对称去芳构化转化反应中(手性质子酸催化下,非活化缺电子N-杂芳烃可实现不对称亲核加成反应)。多数情况下,上述活性吡啶或喹啉盐转化后所得产物中脱保护基步骤必不可少,且反应采用的亲核性有机金属试剂通常是由亲电性有机卤化物制备而来。因此,发展亲电性有机卤化物对非活化N-杂芳烃的对映选择性极性反转加成反应具有重要的研究价值。
近年来,基于芳环碳碳 π-键的去芳构化迁移插入步骤,已发展和建立了一系列新型不对称去芳构化Heck反应、还原Heck反应及亲核捕获串联双官能化反应,实现了由平面型芳香化合物向三维手性环状分子的高效转化。浙江工业大学贾义霞小组在前期对五元杂芳环及萘环等芳香体系的不对称Heck反应的研究基础上,最近对缺电性六元含氮杂芳环展开研究,通过对N-杂芳环C-Nπ-键迁移插入,实现了钴催化的2-邻卤芳基-N-杂芳烃与炔烃的去芳构化不对称[3+2]环化反应。几乎同期,日本理化学研究所侯召民小组与安徽大学罗根小组实现了手性钪催化的2-芳基喹啉与炔烃的[3+2]去芳构化螺环化反应(J. Am. Chem. Soc.2021, 143, 48, 20462–20471)。
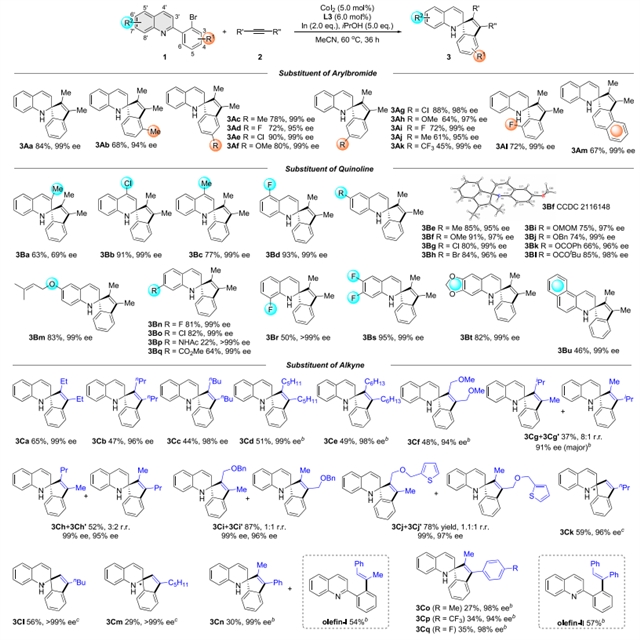
作者首先以2-邻溴苯基喹啉和2-丁炔为模板底物进行反应条件优化,发现使用CoI2催化剂和(R,R)-CHIRAPHOS手性配体,In粉为还原剂、iPrOH为添加剂,在乙腈溶液中反应顺利发生,并以84%的收率和99% 的ee值获得目标的[3+2]螺环化产物。该反应条件温和,底物适用性好,对于含不同取代基的喹啉底物和各种烷基炔烃底物,均能顺利进行,以中等到良好的收率和优异的对映选择性获得相应产物。此外,作者还考察了芳基取代的炔烃底物,发现烷基芳基炔如甲基苯基乙炔的反应可以较低的收率、优异的对映选择性和区域选择性得到螺环化产物3Cn-3Cq,而二苯基乙炔的反应仅能得到烯基化副产物Olefin-II。
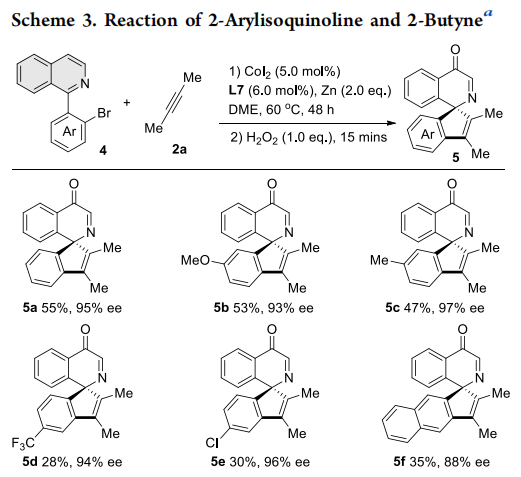
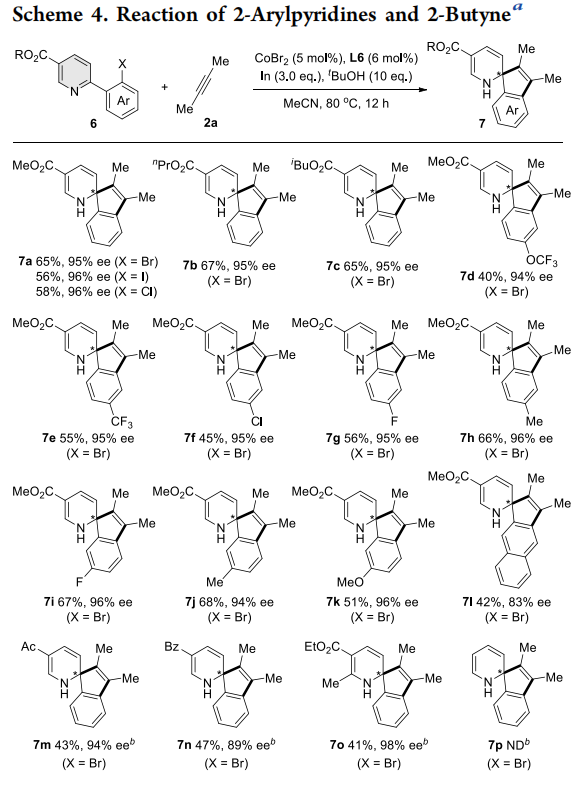
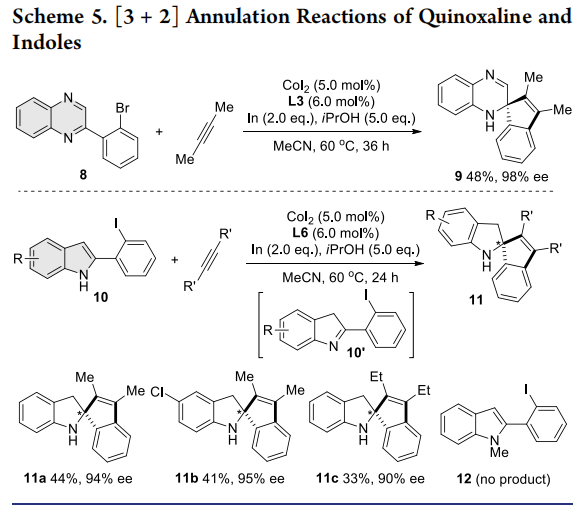
随后,作者进一步研究了异喹啉、吡啶和喹喔啉与二丁炔的[3+2]环化反应。通过反应条件微调,这些缺电性氮杂芳烃的反应均能以优异的对映选择性获得手性螺杂环产物。此外,富电性五元杂环N-H吲哚与二丁炔也能发生反应,以优异的ee值得到C2-螺吲哚林产物11a-11c。该反应可能先经历N-H吲哚异构化为亚胺中间体10’的过程,因为N-甲基保护的吲哚底物12与二丁炔并未发生反应。
总之,浙江工业大学贾义霞小组利用手性Co催化剂,在还原剂In或Zn粉条件下,实现了缺电性N-杂芳烃(喹啉、异喹啉、吡啶、喹喔啉)和富电性N-H吲哚与烷基取代炔烃的对映选择性去芳构化[3+2]极性反转螺环化反应。在温和条件下,以中等到良好的收率和优异的对映选择性合成得到一系列手性螺环二氢(异)喹啉、二氢吡啶,二氢喹唑啉及螺吲哚啉化合物。(来源:科学网)
相关论文信息:https://doi.org/10.1021/jacs.1c11092