|
|
| 中科院上海有机所实现平面手性茂金属化合物合成新方法 |
|
北京时间2022年10月24日,中国科学院上海有机化学研究所游书力团队在Nature Synthesis期刊上发表了一篇题为“Kinetic resolution of planar chiral metallocenes using Rh-catalysed enantioselective C–H arylation”的研究成果。
该课题组利用预官能团化与动力学拆分相结合的策略,实现了平面手性茂金属化合物的不对称合成,该方法可作为一种非常高效的通用手段实现各类1, 2-和1, 3-二取代以及多取代茂金属化合物的不对称合成。
论文通讯作者是游书力研究员;第一作者是刘晨旭博士。
平面手性分子在合成化学、生物医学和材料科学中均具有非常广泛的应用,特别是该类化合物可以作为高效催化剂或配体广泛应用在不对称催化中(图 1a)。因此,开发高效引入平面手性的方法受到化学家们的广泛关注。过渡金属催化的不对称碳氢键官能团化反应在过去几十年中取得了巨大的发展,为手性分子的合成提供了高原子和步骤经济的方法。值得注意的是,利用不对称碳氢键官能团化的方法已经实现了多种平面手性1, 2-二取代茂金属的合成(图 1b)。然而,在以往的工作中每种催化体系均只能引入某一特定官能团,目前仍然缺乏普适性的催化体系可以实现各类官能团的引入。与此同时,由于平面手性1, 3-二取代茂金属的高效合成方法缺乏,限制了相关的应用研究。因此,发展各类官能团化的1, 2-二取代以及1, 3-二取代平面手性二茂铁化合物的高效合成方法具有十分重要的意义。
中国科学院上海有机化学研究所游书力研究员团队一直从事平面手性茂金属化合物的不对称合成研究(Acc. Chem. Res. 2017, 50, 351;Trends Chem. 2020, 2, 737.)。最近,他们通过在带有导向基团的茂金属的2-位或者3-位预先引入一系列官能团,结合动力学拆分的策略实现了一系列1, 2-二取代、1, 3-二取代以及多取代平面手性茂金属的不对称合成(图1d)。反应不仅条件温和、选择性好,而且能够兼容各类官能团。
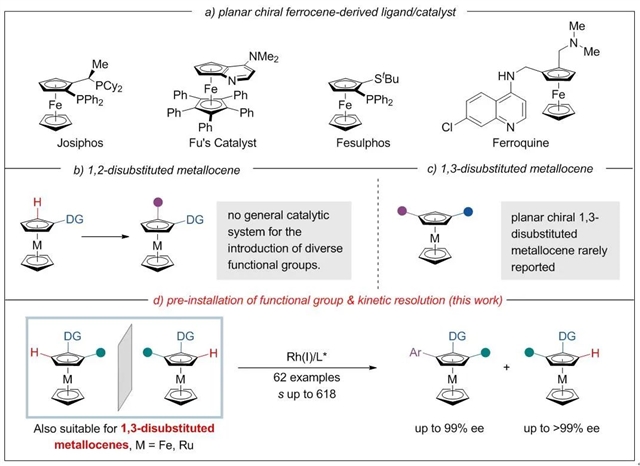
图1:平面手性茂金属化合物的不对称合成
作者通过合理的底物设计,经过系统筛选,确定反应的最优条件:使用乙烯基氯化铑与TADDOL衍生的手性单膦配体作催化剂,叔丁醇锂作为碱,THF作为溶剂可以取得优秀的s值控制。可以在非常温和条件下实现平面手性茂金属化合物的合成,并取得不错的s值控制。在确定了最优的反应条件后,对底物进行普适性考察(图2)。首先对一系列1, 2-二取代的茂金属化合物进行考察。无论吡啶二茂铁或者吡啶二茂钌的2-位带有各类烷基、烯基以及芳基取代基,该反应均可以很好地兼容。另外,将各类杂原子如硅、硫、氟原子引入2-位时,反应依然可以取得不错的结果。
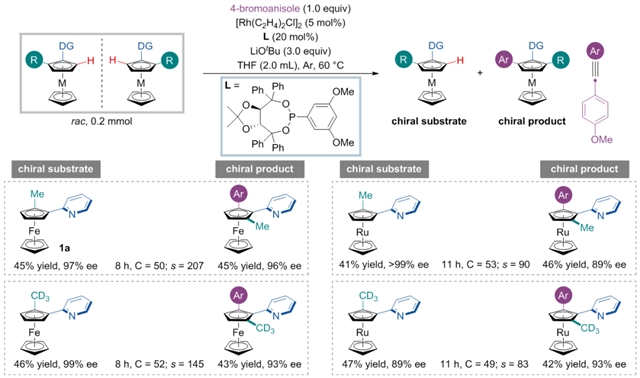
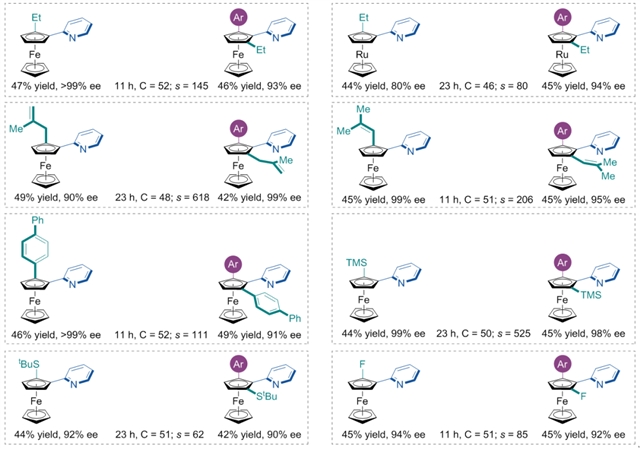
图2:1, 2-二取代茂金属的代表性底物
作者同时尝试了一系列1, 3-二取代二茂铁底物(图3),在吡啶二茂铁的3-位连有三甲基硅基时,在标准反应条件下,反应可以给出非常好的s值控制和优秀的区域选择性控制。3-位为芳基时,反应的s值略有下降。同时一系列取代的吡啶导向基以及各类芳基溴化物也可以很好地兼容该反应,但当芳基溴化物的对位连有吸电子取代基时,反应的s值会略有下降。
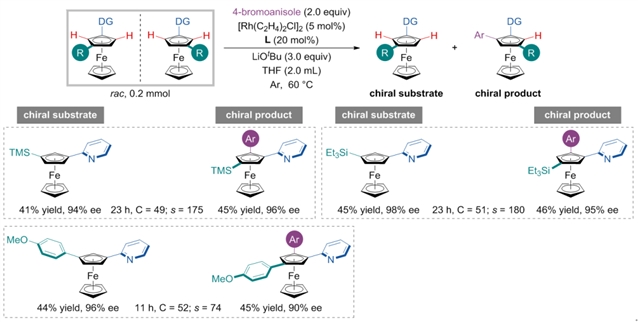
图3:1, 3-二取代二茂铁的代表性底物
另外,作者也将反应放大至2.0 mmol,反应依然可以取得与小反应相当的结果。所获得的平面手性二茂铁化合物,可以应用于新型平面手性N, P-配体的合成,这些配体又可以应用于不对称烯丙基取代和不对称[3+2]环加成反应。作者也进行了动力学实验,分别将(Rp)-1a和(Sp)-1a投入到标准反应中对其进行速率检测,发现(Rp)-1a与(Sp)-1a速率之比为195,这与实验计算出的s值(207)相吻合。
该研究提供了合成平面手性茂金属化合物的新方法,利用预官能团化和动力学拆分相结合的策略实现了一系列茂金属化合物的不对称合成。该方法为合成平面手性1, 2-二取代、1, 3-二取代以及多取代茂金属化合物提供了新的途径。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-022-00177-3