北京时间2022年10月10日,厦门大学化学化工学院的徐海超教授团队在Nature Catalysis期刊上发表了一篇题为“Photoelectrochemical asymmetric catalysis enables site- and enantioselective cyanation of benzylic C–H bonds”的研究成果。该团队开发了首例光电催化不对称合成方法,实现了苄位C(sp3)–H键的高效不对称氰化反应。
徐海超教授为该论文的通讯作者,博士生蔡晨燕和赖小丽为共同第一作者。
徐海超课题组长期致力于有机电合成研究。该团队前期将电化学与分子光催化结合,开创了分子光电催化合成新领域(Angew. Chem. Int. Ed.2019, 58, 4592)。分子光电催化结合了电化学和分子光催化二者的互补优势,有望实现通过单一策略不易达成的合成方法。该领域的一个主要挑战是,没有任何策略可以精确控制手性产物形成的绝对立体化学。鉴于手性在有机分子中的重要性,光电不对称催化方法的发展无疑将大大增强分子光电催化的效用并促进领域的进一步发展。
团队选择开发一个位点和对映体选择性光电催化卞位C(sp3)-H氰化反应作为其在光电不对称催化方面的首次尝试。值得指出的是,Stahl和Liu前期的开创性工作利用当量NFSI试剂和铜催化实现了该不对称转化(Science2016, 353, 1014)。该自由基介导的不对称碳氢官能团化通过氢原子转移(HAT)切断C-H键形成碳自由基中间体。徐海超课题组则另辟蹊径,通过分步电子/质子转移实现高区域选择性C-H断裂(图1)。
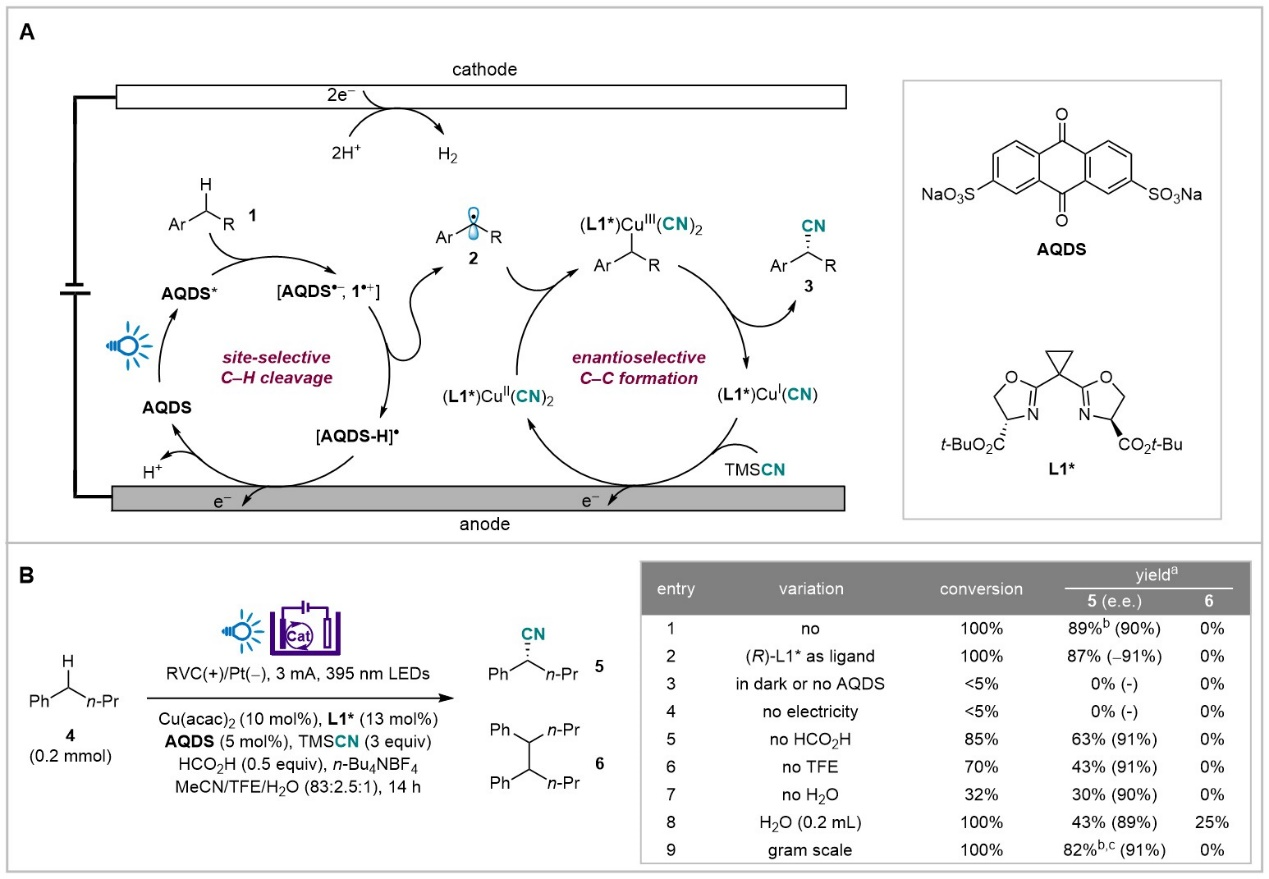
图1:反应设计及发展
作者对反应条件进行了系统的优化,实验结果表明,使用AQDS作为光催化剂可顺利得到苄基自由基,并且通过加入水、TFE以及酸性添加剂,通过调控该苄基碳自由基形成的速率从而与后续氰基化步骤得以匹配。在最优条件下,作者随后对底物范围进行了考察。结果表明,该光电催化方法具有底物范围广、官能团兼容性强、区域和立体选择性高的特点。对于不同电性的芳环,该反应都能得到比较好的结果。当底物中同时存在有不同电性的芳环,氰化反应能选择性在富电子苯环所在的苄位发生(图2)。之后,作者通过对产物中氰基进一步的转化展示了该方法学的实用性(图2)。
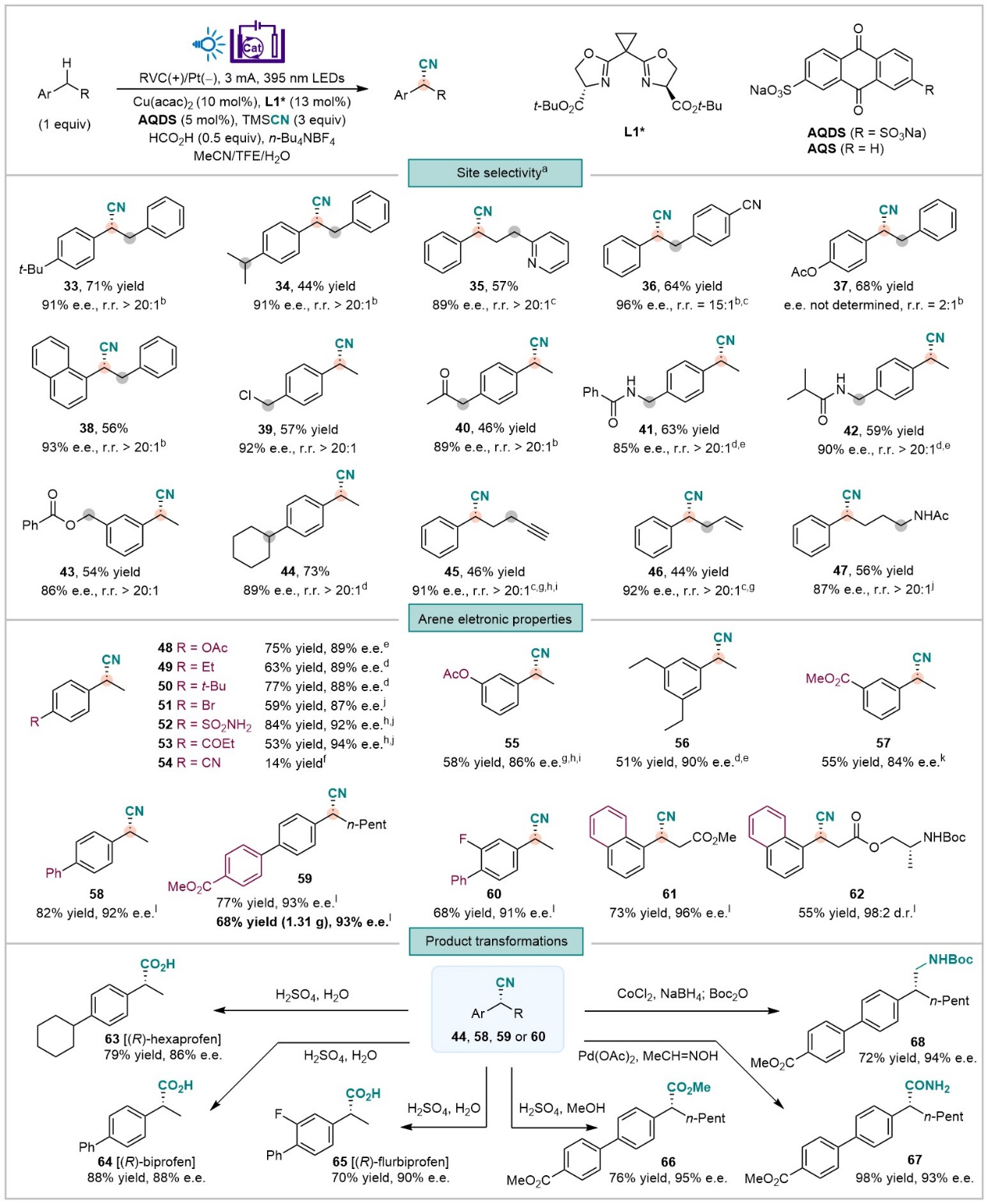
图2:苄位氰基化反应底物范围和产物转化
作者通过系列机理实验验证了所提出的反应机制,包括测定底物氧化电势和光催化剂激发态还原电势、捕获苄基自由基中间体、分析Hammett曲线、探究特殊底物断键规律,以及测定动力学同位素效应等。
总之,徐海超课题组发展了首例光电不对称催化方法,实现了无氧化试剂的不对称苄位C(sp3)-H氰化反应。未来的工作重点是将光电不对称催化方法应用于C(sp3)-H键与其他亲核试剂的对映选择性反应。该工作证明可以将分子光电催化和不对称催化结合起来实现高效的对映选择性C-H官能团化,这对立体选择性和可持续合成的进一步发展具有重要的意义。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41929-022-00855-7