|
|
| 钱俊斌等揭示乳腺癌免疫治疗作用机制并提出预测疗效新方法 |
|
2021年5月7日,国际知名的Nature Medicine杂志在线刊登了由浙江大学、比利时鲁汶大学和VIB研究所等组成的国际团队的最新合作研究成果。该研究利用单细胞多组学测序技术分析了乳腺癌免疫治疗前后的肿瘤微环境改变,揭示了抗PD-1治疗的作用机制并提出了预测疗效的新方法。
浙江大学医学院附属妇产科医院的钱俊斌研究员、比利时鲁汶大学医院Ann Smeets教授和比利时VIB研究所Diether Lambrechts 教授为本研究的共同通讯作者。
近年来以免疫检查点抑制剂(ICB)为代表的免疫治疗药物在多种肿瘤的治疗中取得了巨大成功,大大提升了部分肿瘤病人的生存率和生活质量。近期的乳腺癌临床试验数据表明,ICB联合新辅助化疗可提高患者完全缓解率和无事件生存率,而ICB单药的新辅助治疗也有望成为乳腺癌治疗的常规选项之一。但相较于黑色素瘤和肺癌,以抗PD-1/PD-L1抗体为代表的ICB疗法在乳腺癌的治疗中表现尚不尽人意,亟需进一步研究病人对此类药物缺乏反应的原因和研发预测新辅助治疗获益人群的新方法来指导精准医疗实践。
该研究对乳腺癌患者进行了“机会窗口” 临床试验,即对29名初诊病人和11名经过新辅助化疗的病人进行肿块细针活检后给予10天左右抗PD-1抗体治疗,然后再手术切除肿块,并对免疫治疗前后的活检和术后肿块组织进行单细胞转录组联合免疫组库测序(scRNA-seq + scTCR-seq)以及单细胞转录组联合蛋白组测序(CITE-seq),并分析了免疫治疗前后肿瘤微环境内细胞组分的变化,从而鉴定出对免疫治疗结局有潜在贡献的特定细胞类型,特别是与T细胞克隆增殖相关联的细胞亚型 (图1)。
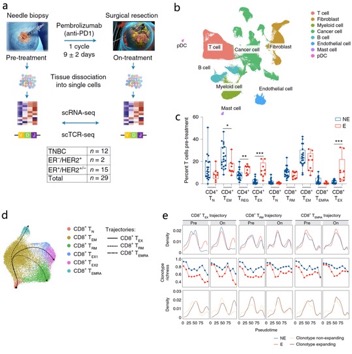
图1:研究设计方案和免疫治疗前后肿瘤微环境的改变。
通过对比治疗前后出现T细胞克隆增殖与未出现克隆增殖病人的免疫微环境改变,该研究揭示了多种免疫细胞在免疫治疗中的分化规律, 以及可能的作用机制。如该研究提示表达PD-1的CD4+和CD8+T细胞亚型是抗PD-1治疗的主要靶点细胞, 其中CD8+TEX细胞和辅助性CD4+T 细胞(TH1, TFH)所对应谱系的分化程度和克隆增殖情况可以用来预测PD-1治疗的反应,而且PD-1治疗可能进一步促进此类细胞的分化。此外,CCR2+或 MMP9+等巨噬细胞和多种树突状细胞亚型均与治疗反应呈正相关,而CX3CR1+巨噬细胞的比例与T细胞的克隆增殖呈负相关。该研究进一步发现乳腺癌中表达PD-L1的主要细胞类型并非肿瘤细胞而是巨噬细胞和树突状细胞,而后两者的PD-L1高表达可预测免疫治疗反应。最后,该研究通过生信分析挖掘了能够预测免疫治疗反应的生物标记物,并有望在筛选潜在获益人群的临床治疗分层实践中得到应用(图2)。
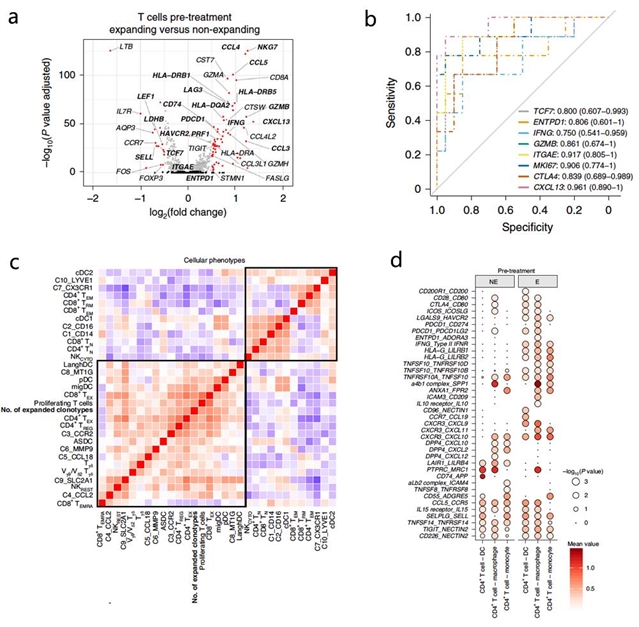
图2:免疫微环境特征与生物标志物。
该临床研究的特点在于抓住了免疫治疗前后10天左右这一短暂的时间窗口,观察到免疫治疗诱导肿瘤微环境改变的初期特征,是全面理解免疫治疗整个疗程作用机制的关键组成部分,对临床实践具有重大指导意义。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41591-021-01323-8