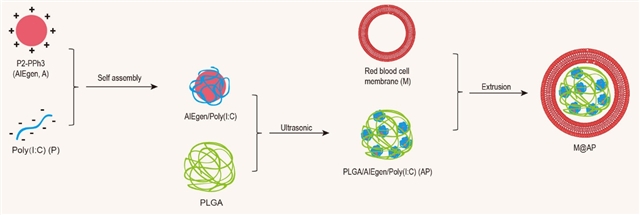
聚集诱导发光仿生探针M@AP的合成示意图
在近日发表于《国家科学评论》(National Science Review, NSR)的文章中,研究者利用红细胞膜负载聚集诱导发光(AIE)光敏剂和免疫佐剂Poly(I:C),在小鼠模型中实现了对肿瘤的高效光动力-免疫协同治疗。文章通讯作者为华中科技大学王世宣教授、中国地质大学(武汉)夏帆教授和乐卓博大学洪煜柠(Yuning Hong)教授。
光动力治疗(Photodynamics therapy,PDT)的原理是:将光敏剂引入肿瘤后,光照作用下,光敏剂会诱导肿瘤细胞产生过量活性氧,以杀死肿瘤细胞;同时,PDT还可以促进肿瘤相关的抗原释放,从而启动机体的抗肿瘤免疫。聚集诱导发光(Aggregation-Induced Emission,AIE)光敏剂在聚集状态下具有更强的光敏活性,因此适用于PDT [1]。但是,仅依靠PDT依旧很难彻底清除肿瘤。因此,在这项研究中,研究者将PDT与免疫佐剂Poly(I:C)相结合,利用红细胞膜同时负载AIE光敏剂和Poly(I:C),构建出M@AP探针,实现了对肿瘤的高效光动力-免疫协同治疗。
Poly(I:C)是一种Toll样受体3激动剂,可直接诱导肿瘤细胞凋亡,并促进肿瘤细胞分泌免疫因子。然而,Poly(I:C)诱导的免疫应答率在一定类型的恶性肿瘤中仍然很低,且Poly(I:C)具有较大的细胞毒性,使其临床应用收到极大限制 [2]。在体内,M@AP会富集于肿瘤组织(实体瘤具有高通透性和滞留效应,EPR effect)和脾脏(脾脏是破损红细胞的归巢清除场所)。在肿瘤组织中,给予光照治疗时,AIE光敏剂产生过量的活性氧,与Poly(I:C)共同作用,诱导肿瘤细胞死亡,同时促进肿瘤抗原释放入血、激活机体的免疫反应。在脾脏内,Poly(I:C)则诱导免疫细胞分泌大量免疫因子,协同激活机体免疫。
体内实验表明,M@AP探针在光照下不仅可以直接杀死肿瘤细胞,在Poly(I:C)的协同作用下还可以活化免疫细胞,促进细胞因子白细胞介素1(IL1)、白细胞介素6(IL6)、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)的释放,从而实现对肿瘤的高效光动力-免疫协同治疗。更有意思的是,在黑色素瘤肺转移小鼠模型中,M@AP探针也显示出色的抗转移癌的能力,这将为肿瘤复发和转移治疗提供可能性。(来源:科学网)
相关论文信息:https://doi.org/10.1093/nsr/nwab039