|
|
| 是它是它就是它,一种新型lncRNA带来的抗癌新思考 | Cancer Communications |
|
论文标题:A novel role of LncRNA in regulating tumor metabolism and angiogenesis under hypoxia
期刊:Cancer Communications
作者:Jie Luo, Lee F. Langer and Jian Liu
发表时间:2019/02/04
数字识别码:10.1186/s40880-019-0348-x
原文链接:https://cancercommun.biomedcentral.com/articles/10.1186/s40880-019-0348-x?utm_source=other&utm_
medium=other&utm_content=null&utm_campaign=BSCN_2_DD_Cancercommun_Arti_Scinet
微信链接:https://mp.weixin.qq.com/s/cybNvdI1_sIPDS9Jzm5GkQ
肿瘤细胞的特点是代谢过程的重编程,这是支持其对能量和营养物质的高需求所必需的步骤。探索代谢重编程与微环境重构之间的协同效应有助于发现新的生物标志物和治疗靶点。Jie Luo等人在Cancer Communications上发表的一篇研究亮点文章中重点介绍了Sang的团队发现的这种新型的lncRNA(CamK-A)在低氧条件下对肿瘤代谢和血管生成的调节作用。
钙作为细胞信号调节中的重要第二信使。正常情况下,细胞内钙通过激活钙调素(CaM)和CaM激酶(CaMKs)发挥其信号功能。尽管对钙流是如何对钙信号传导和其他途径之间的相互关联进行调节还不清楚,但最新的研究已经确凿地证明了钙流在肿瘤的进展中起着关键作用。在这篇名为“LncRNA CamK-Aregulates Ca(2+)-signaling-mediated tumor microenvironment remodeling” 的文章中,Sang的团队介绍了一种新的lncRNA——用于钙依赖性激酶活化的lncRNA(CamK-A),研究表明它可以介导钙信号传导与活化B细胞(NF-κB)通路的核因子kappa轻链增强子之间的相互作用,从而促进Warburg效应、微环境重塑和肿瘤的发展(图1)。

图1. 在一场史无前例的暴雨(低氧肿瘤中的钙通量)中,龙王(lncRNA CamK-A)抓住了两个龙珠(PNCK和IκBα),导致了汹涌的海水——代表了肿瘤的微环境。幸运的是,英雄哪吒手持混天绫(siRNA)和乾坤圈(RNAi),征服了龙王,拯救了人类,反映了CamK-A靶向治疗在癌症治疗中的潜在应用。
Sang等人通过RNA干扰(RNAi)耦合葡萄糖摄取和乳腺癌细胞的MTT测定来鉴定CamK-A。通过进一步分析乳腺癌组织中CamK-A的表达水平与乳腺癌患者生存状态之间的关系,发现CamK-A表达与癌症的进展显著相关。此外,包括体外活性测定和体内异种移植物生成测定在内的功能性研究表明,CamK-A能够促进肿瘤生长和增强肿瘤的进展。
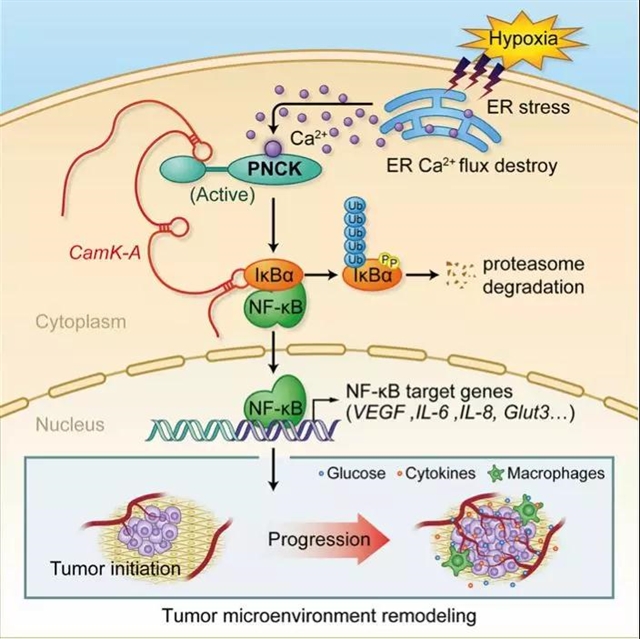
图2. 研究图示
RNA pull-down和质谱分析显示,CamK-A是妊娠上调、非泛素化表达CaMK激酶(PNCK)和NF-kappa-B 抑制剂α (IκBα)的结合伴侣。通过体外激酶分析,作者证明CamK-A能促进三阴性乳腺癌(PNCK)的激活,使激酶在Ser32位点对IκBα进行磷酸化,最终激活钙诱导的NF-kB信号通路。与这一结果相支持的是:一个通路报告子的阵列分析证实了NF-κB路径是由CamK-A调控的。因此,作者阐述了一个模型:CamK-A能促进PNCK的自我激活,IκBα的磷酸化,以及激活随后的NF-κB信号通路。
Sang的团队还发现了缺氧和钙信号之间的重要联系。具体来讲,缺氧可诱导细胞活性氧生成和内质网的应激反应,导致细胞溶质钙水平的升高。这一过程被认为是刺激实体肿瘤生长的一个重要的微环境因素,但具体细节仍不清楚。他们提到通过增加肿瘤细胞溶质的钙浓度,低氧条件下便可激活PNCK-CAMK-A-NF-κB轴及其下游靶基因,包括葡萄糖转运蛋白3(GLUT3)、白细胞介素6(IL-6)、白细胞介素8(IL-8)和血管内皮生长因子(VEGF)。这一机制可以诱导不受控制的葡萄糖摄取、肿瘤相关巨噬细胞募集、肿瘤内血管生成和肿瘤微环境的重塑。
研究人员普遍认为核因子抑制剂kappa-B激酶(IKKs)通过磷酸化IκBα来激活NF-κB通路。因此,人们认为CamK-A通过IKKs来调节NF-κB通路。然而,Sang的这项研究表明,无论是敲除还是敲减IKK亚单位β(IKKβ)都不影响PNCK-CAMK-A轴介导的IκBα磷酸化。这一发现表明,CamK-A可以以独立于IKKs的方式来激活NF-κB通路,为我们对钙依赖性NF-κB通路激活的理解提供了一个重要的依据。
临床样本分析显示,与邻近正常组织相比,CamK-A在肿瘤组织中具有很高的表达水平,且其高表达与乳腺癌患者的不良临床结局相关。Sang等人使用病人来源的TNBC异种移植模型(PDX)研究了CamK-A在肿瘤发生中的作用。在这个系统中,使用体内优化的RNAi抑制CamK-A导致了对肿瘤增殖、微血管肿瘤生长、巨噬细胞募集的强有力的抑制,从而导致肿瘤微环境的重塑。这些强有力的数据为CamK-A抑制剂的进一步的临床应用铺平了道路。令人兴奋的是,新型RNAi药物Patisiran(ONPATTOR™)最近已获得美国食品药品监督管理局的批准,未来几年可能会开发出更多的RNAi药物。鉴于这些大分子的组织特异性,lncRNA靶向药物可能有助于RNAi药物的出现。探索Camk-A的治疗可能性将是这条道路上令人兴奋的一步。
总之,在肿瘤低氧的条件下,lncRNA CamK-A 激活钙信号通路,进而诱导 CamK-A依赖性NF-κB通路的激活和肿瘤微环境的重塑。此外, CamK-A在肿瘤发展中起着关键作用,这种lncRNA的干扰可以有力地阻止癌症的进展,强化其在抗癌治疗中的潜在效果。
阅读论文全文请访问:
https://cancercommun.biomedcentral.com/articles/10.1186/s40880-019-0348-x?utm_source=other&utm_
medium=other&utm_content=null&utm_campaign=BSCN_2_DD_Cancercommun_Arti_Scinet
期刊介绍:
Cancer Communications(https://cancercommun.biomedcentral.com/,*3.822 -2-year Impact Factor, *3.644 -5-year Impact Factor) is an open access, peer-reviewed online journal that encompasses basic, clinical, and translational cancer research. The journal welcomes submissions concerning clinical trials, epidemiology, molecular and cellular biology, and genetics.
(来源:科学网)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。