图1:小鼠胚胎造血干细胞形成过程中单细胞分辨率的发育路径示意图
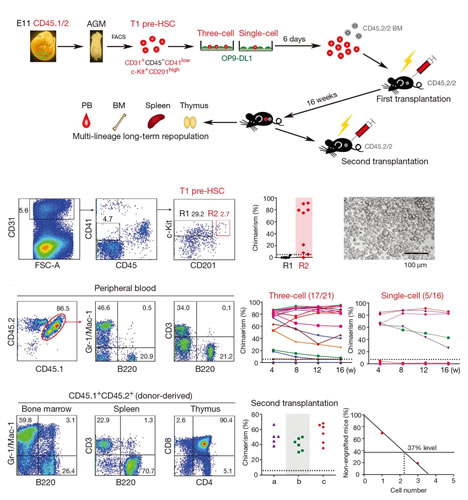
图2:小鼠胚胎造血干细胞形成过程的单细胞功能分析
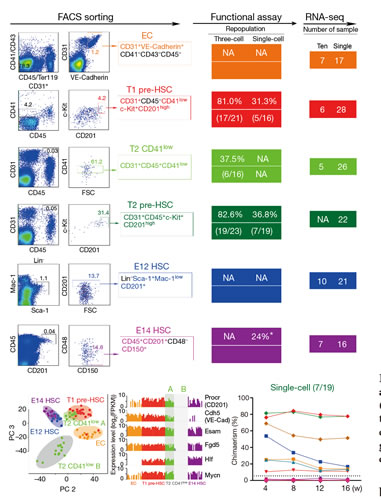
图3:小鼠胚胎造血干细胞形成过程的单细胞转录组分析
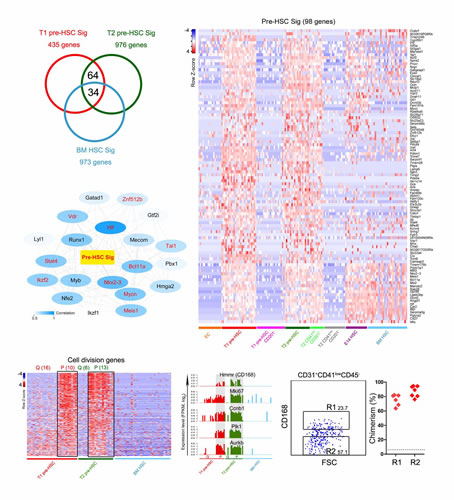
图4:小鼠胚胎造血干细胞形成过程的细胞周期异质性及其功能分析
北京时间2016年5月19日凌晨国际知名学术期刊《自然》以长文章(Article)的形式在线发表了北京大学
学院生物动态光学成像中心汤富酬研究组和军事医学科学院附属医院(解放军307医院)刘兵研究组、中国医学科学院天津血液病医院(血液学研究所)袁卫平研究组的最新研究成果——在单细胞分辨率解析造血干细胞的形成过程(Tracing haematopoietic stem cell formation at single-cell resolution)。该项工作在功能和基因表达方面在单细胞水平上系统、深入地研究了小鼠造血干细胞形成和特化过程中的关键特征。
造血干细胞(hematopoietic stem cell,HSC)是包括人类在内的哺乳动物体内所有血液细胞的干细胞,在合适的条件下只要造血干细胞的一个单细胞就可以在体内产生所有类型的血液细胞,因而对哺乳动物血液系统功能的长期维持和稳定起关键作用。精确地分离单个具有功能的干细胞是开展后续一系列研究的前提条件。作为干细胞生物学最有代表性的细胞类型,造血干细胞的研究一直广受关注。早在1996年,国际上就首次实现了成体骨髓造血干细胞的单细胞分离。然而,在胚胎发育早期,造血干细胞数量非常稀少,而且缺乏特异性的表面标志,使对其发生过程的研究异常困难。在本项研究中,刘兵研究组通过大量前期工作、筛选获得新的特异性表面标志,结合新颖的单细胞诱导移植体系,最终实现了造血干细胞前体(pre-hematopoietic stem cell,pre-HSC)的高效单细胞捕获。随后,刘兵研究组与汤富酬研究组密切合作,针对造血干细胞发育过程中具有代表性的5类细胞(血管内皮细胞,I型和II型造血干细胞前体,胚胎12天和胚胎14天的造血干细胞)进行单细胞转录组高通量测序,首次揭示了造血干细胞前体在转录活性、动静脉基因表达、代谢状态、信号通路和转录因子网络等方面的核心特征。该项研究发现流式细胞仪分选得到的II型造血干细胞前体(type II pre-HSCs)实际上混有大量的分化后的成熟血液细胞,通过单细胞转录组分析找到了新的II型造血干细胞前体特异性表达的细胞表面标志基因CD201,并进而利用这一新的标志基因将II型造血干细胞前体的分选纯度大幅度提高。其次发现了I型和II型造血干细胞前体的细胞周期异质性。进一步的功能分析发现处于S/G2/M期和G0期的I型造血干细胞前体均有经过诱导后重建受体小鼠血液系统的能力,这完全不同于成年小鼠骨髓造血干细胞,后者只有在G0期才具备移植后重建受体小鼠血液系统的能力。更重要的是,利用单细胞mRNA绝对定量的方法,该项研究还发现在血管内皮细胞特化成I型造血干细胞前体的过程中,单个细胞的转录活性提高了5倍左右,mTOR信号通路的活性特异性增强,说明造血干细胞前体是转录特别活跃、mTOR信号通路为代表的代谢活性也非常活跃的细胞类型,完全不同于成年小鼠中处于静息状态的骨髓造血干细胞。基于这些发现,刘兵研究组与袁卫平研究组展开深入合作,利用血管内皮细胞和造血细胞特异性的两种Rictor基因条件敲除小鼠模型阐明了mTORC2信号通路在造血干细胞的形成和特化过程中发挥关键作用,而在此后造血干细胞的维持过程中并非必需。这说明在从血管内皮细胞特化形成造血干细胞前体的细胞类型转换过程中,mTOR信号通路相关的代谢过程特异性地起了重要作用。最后,通过与更多细胞群体的单细胞转录组测序数据的深入对比分析,发掘出造血干细胞前体特异性表达的98个核心基因。综上所述,该项研究工作为阐明包括人类在内的哺乳动物造血干细胞的体内发生和特化、形成和维持的分子机制提供了研究基础,也为发掘多能性干细胞向造血干细胞的定向分化、以及造血干细胞的体外再生等研究提供了新的研究线索、思路和理论依据。
军事医学科学院附属医院的博士生周帆、周杰博士、贺文艳博士,北京大学的博士生李显龙、博士生朱平,中国医学科学院天津血液病医院的助理研究员王伟丽是这篇论文的并列第一作者。北京大学
学院生物动态光学成像中心的汤富酬研究员、军事医学科学院附属医院的刘兵研究员、中国医学科学院天津血液病医院的袁卫平研究员是该论文的共同通讯作者。该项研究得到了国家自然科学基金、科技部国家重大科学研究计划、以及北大清华联合中心基金等支持。(来源:北京大学)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。