血管化类脑器官移植 图片来源:中国科学院生物物理研究所
中国科学院生物物理研究所研究员王晓群课题组长期致力于脑的发育与功能的研究,近年来,该课题组对于人大脑皮层胚胎发育期间细胞类型与细胞特征进行了系统分析,并揭示了人脑神经元在胚胎发育期快速增长并产生沟回的调控机制。
跨物种研究表明人类及非人灵长类动物的大脑皮层发育呈现出了有别于其他低等动物(如啮齿类)的一些特点,例如出现了包含大量oRG神经前体细胞和IPC中间神经前体细胞的外侧脑室下区(OSVZ区),这些神经前体细胞种类的多样性和丰富的数量促进了神经元的高速产生,为人脑的复杂功能发育提供了细胞基础。
为了深入研究该领域,王晓群课题组早在2012年首先开展了类脑皮层培养的技术的建立,并应用该技术在体外模拟了ASPM基因突变引起的头小畸形症发育和发展过程,并研究了其病理特征。目前,与传统的二维培养方法相比,三维类脑器官具有与人脑类似的发育特点和结构,能够很好地模拟细胞类型不断丰富的动态变化及神经环路形成等过程。因此,三维类脑器官近年来越来越多的应用于探究人脑早期发育的研究。
另外,类脑器官在探究脑疾病的病理机制和高通量药物筛选等方面也展现出了广阔的应用前景。但是,由于缺乏循环系统的参与,传统的类脑器官的长期培养很大程度上受限于内部氧气和营养物质供应不足所导致的低氧和内部细胞死亡,使得类脑器官不能进行长期培养。
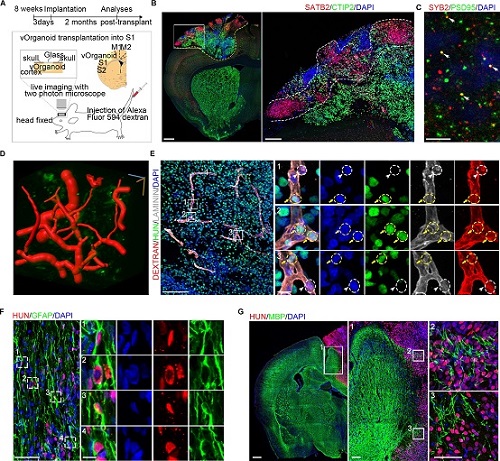
近日,王晓群联合北京师范大学教授吴倩在《科学公共图书馆—生物学》在线发表了相关研究成果。该研究通过共培养人胚胎干细胞(或人多能干细胞)和人脐静脉内皮细胞(HUVECs)建立了一种获得血管化类脑器官的方法,很好地解决了限制类脑器官长期发育的氧气和营养物质缺乏问题。
该研究还证实了HUVECs血管网络能够加速类脑器官的成熟发育,使其更早的达到成熟状态。而进行体内移植之后,类脑器官血管网络中的内皮细胞可以整合到宿主小鼠的血管中而形成新的有血液流动的功能性血管网络。此外,膜片钳全细胞记录表明血管化类脑器官中的神经元能够发放动作电位,并建立广泛的电突触及化学突触联系。
这些结果说明,本研究建立的血管化类脑器官在细胞类型、细胞排布、转录组模式及电生理特性等方面都很好地模拟了人胚胎期大脑皮层的特征,因此是研究人皮层发育及相关疾病的良好模型。
为了探究类脑器官在移植中应用的可能性,研究团队将血管化的类脑器官移植到免疫缺陷小鼠的S1脑区。他们发现类脑器官血管网络可以整合到宿主小鼠的血管中形成新的有血液流动的功能性网络,同时减少了移植物的细胞凋亡。
类脑器官有望在未来应用于脑疾病的深入研究或治疗,例如脑外伤的治疗应用。血管化类脑器官的建立将为实现类脑器官的优化培养、促进其功能成熟,以及为建立体外三维血脑屏障模型提供新的研究思路及方案,具有重要的生物学和医学应用潜力。
相关论文信息:https://doi.org/10.1371/journal.pbio.3000705
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。