蛋白质错误折叠与疾病的研究一直是 领域的研究热点之一。
北京时间2020年6月8日晚23时,《自然—结构与分子生物学》(Nature Structural & Molecular Biology)以长文(Article)形式在线发表了武汉大学团队和中国科学院上海有机所交叉中心团队的最新研究成果。
研究人员首次在原子水平上解析了全长朊病毒蛋白纤维的高分辨率冷冻电镜结构,揭示了细胞型朊蛋白向病理型朊病毒蛋白结构转变的分子机制,为发展新的基于朊病毒蛋白纤维结构的prion疾病治疗药物奠定了基础。
武汉大学 学院教授梁毅和中国科学院上海有机所交叉中心教授刘聪为该论文的共同通讯作者,武汉大学 学院博士生王利强和中国科学院上海有机所交叉中心博士生赵焜为该论文的共同第一作者,华中农业大学 技术学院殷平教授和武汉大学 学院博士生袁菡烨等参与了该论文的研究工作。
这项研究工作得到了国家自然科学基金委和科技部的资助。
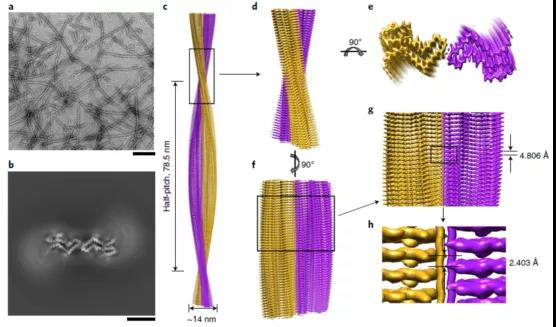
全长人朊病毒蛋白纤维的冷冻电镜结构
传染性海绵状脑病(TSE)或prion疾病是一类致死的神经退行性疾病,由朊病毒蛋白(PrP)在体内发生错误折叠而引起,影响包括人在内的多种哺乳动物。
朊病毒蛋白由宿主基因PRNP编码,正确折叠的蛋白质不仅没有致病性和感染性,还具有重要的生理功能;其错误折叠后则会转变为具有感染性的朊病毒(prions),能够使许多哺乳动物患病,给人类健康带来了重大威胁。
1997年诺贝尔生理或医学奖得主S. B. Prusiner教授最先描述了朊病毒,即蛋白质感染因子。
在人和其他哺乳动物中,常见的prion疾病有疯牛病(BSE)、羊瘙痒症(Scrapie)及人的克雅氏病(CJD)、致死性家族失眠症(FFI)和格斯特曼氏综合征(GSS),还有鹿科动物的慢性消耗病(CWD)等。
Prion疾病的主要病理特征为PrP由细胞型朊蛋白(PrPC)转变为病理型朊病毒蛋白(PrPSc),PrPSc和PrP的淀粉样纤维可以作为模板诱导PrPC发生构象转变。
“冷冻电镜(Cryo-EM)技术为蛋白质错误折叠与疾病带来革命性的进展;解析PrPSc和全长PrP纤维的高分辨率结构将为理解prion疾病的发病机制起到极大的推动。”论文指出。
但迄今为止,由于PrPSc和PrP纤维的不溶性和异质性,仍无高分辨率的PrPSc和全长PrP纤维的结构,极大地限制了基于PrP纤维结构的prion疾病治疗药物的研发。
梁毅介绍,为了阐释细胞型朊蛋白向病理型朊病毒蛋白转变的结构基础,在这项研究中,研究人员制备了高度均一的全长人朊蛋白淀粉样纤维,并运用冷冻电镜结合三维重构技术在原子水平上解析了全长朊病毒蛋白纤维的高分辨率结构(2.70 Å),发现朊蛋白纤维由两股原纤维以左手螺旋的方式缠绕而成,纤维宽度为25 nm,纤维核心直径是14 nm,半个螺旋周期为78.5 nm。
进一步研究发现,PrP纤维核心主要由其C端的170-229组成,包含6个β-折叠结构(从β1到β6)。
在PrP聚集过程中,两股原纤维通过Lys194和Glu196之间形成的盐桥发生相互作用,在其相互作用的界面处形成了一个亲水腔。
对于这样新奇的结构,研究人员对于其病理学意义进行了探索,发现在PrP纤维结构中形成盐桥的三个关键氨基酸残基Lys194、Glu196和Glu211都是与prion疾病相关联的病理突变位点。
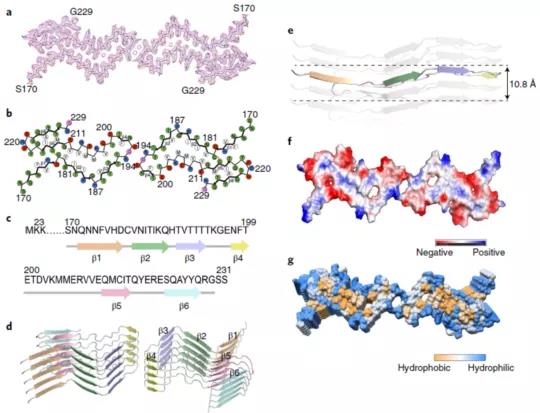
全长人朊病毒蛋白纤维的原子结构模型
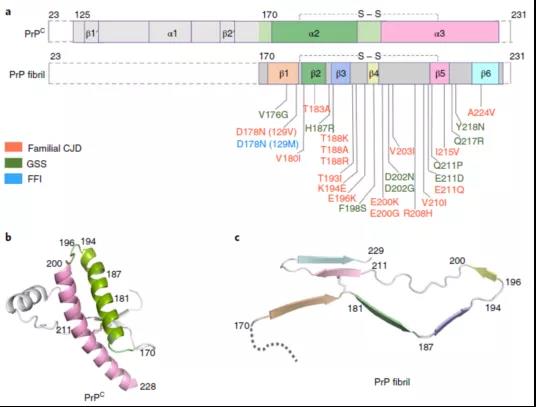
人野生型PrPC和PrP纤维结构比较
基于上述结论,研究人员提出,在PrP错误折叠过程中,PrPCC端的两个α-螺旋转变成PrP纤维的六个β-折叠结构,Cys179和Cys214之间的二硫键起到了稳定淀粉样纤维结构的作用。
该研究首次在原子水平上揭示了PrP由PrPC向PrPSc结构转变的机制,启示不同的病理突变体在调节朊病毒蛋白构象转化中可能发挥着不同的作用,并使得发展新的基于PrP纤维结构的prion疾病治疗药物成为可能,为PrPSc结构与致病功能的深入研究奠定了分子基础。(来源:科学网)
相关论文信息:DOI:10.1038/s41594-020-0441-5