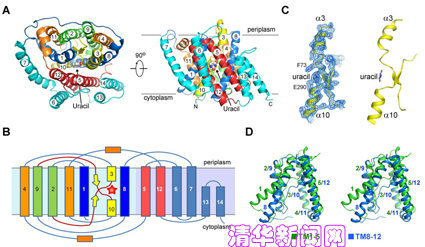
图为UraA三维晶体结构
3月20日,清华大学医学院教授、生命学院兼职教授颜宁和生命学院王佳伟副研究员合作领导的科研小组,在《自然》(Nature)发表了名为“Structure and mechanism of the uracil transporter UraA”(尿嘧啶转运蛋白UraA的结构和机制)的科研论文,在世界上首次解析了NAT(Nucleobase/Ascorbate Transporter,核苷碱基-维生素C转运蛋白)家族蛋白UraA的晶体结构,由此解决了困扰广大生物学家的一大难题。
各种核苷碱基(nucleobases)以及维生素C的吸收由一类跨膜转运蛋白家族NAT蛋白介导。而他们通过怎样的机制完成跨膜转运,一直是个谜。 核苷碱基-维生素C转运(NAT)蛋白家族,又称为核苷碱基-阳离子同向转运载体2(NCS2)蛋白家族,在各种生物核苷碱基摄取的生理活动中发挥着重要作用。核苷碱基作为DNA、RNA的重要组成成分,是各种生物必需的分子,而维生素C则在人类健康中起着关键的作用,众所周知,维生素C的摄入不足会导致坏血病。因此,知晓NAT家族蛋白的三维结构信息以及其发挥生理活性的机制结构至关重要。 颜宁研究组此次解析UraA的晶体结构及其机制则揭晓了这一谜底。
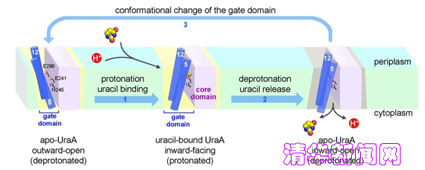
该科研小组研究人员经过结构分析,发现UraA在空间排布上呈现两个明显的结构域,即核心结构域和门控结构域。在已有的结构基础上,他们通过大量的体内体外生化实验进一步证明了该蛋白特殊结构的生理意义:蛋白底物尿嘧啶在跨膜转运的过程中首先被准确地定位在两个结构域之间,进而通过核心结构域和门控结构域之间的构像变化完成整个转运过程。他们还发现了在底物识别共转运中起关键作用的数个氨基酸。科研小组根据序列比较,进一步提出了NAT家族利用钠离子或质子共转运底物的分子机理。
颜宁教授率领的科研小组自建立以来即致力于对膜转运蛋白结构,特别是营养物质——质子共转运蛋白的结构与分子机理的研究。他们在2007年开始了对NAT家族蛋白的研究,首先选取了大肠杆菌尿嘧啶-质子共转运蛋白(Uracil:proton Symporter)UraA这一该家族代表性成员作为研究对象,利用现代结构生物学的方法,终于在2010年4月首次获得了UraA与底物尿嘧啶高达2.8埃的高分辨率三维精细结构。通过对三维晶体结构的分析,他们惊喜地发现:在拥有由14个跨膜片段形成的两个反向重复序列的UraA蛋白中,存在着一种全新的蛋白折叠形式。在第3号和第10号跨膜片段间存在着一对反向平行的beta-折叠片,它们在蛋白结构的维持和蛋白底物的识别中发挥了重要作用。
这一发现基本颠覆了一直以来对于膜整合蛋白结构的认知。过去25年的膜蛋白结构生物学研究似乎表明,膜整合蛋白的跨膜区或者只有alpha螺旋,或者只有beta折叠。唯一的例外是S2P蛋白,其在膜边缘处还有三个beta折叠,由于是出于蛋白边缘,还一度被专家质疑是否是由于体外结晶造成的结构变相。而UraA的结构毫无疑义地证明alpha螺旋和beta折叠两种蛋白二级结构可以在膜蛋白的跨膜区中同时存在,这一发现为研究膜蛋白的折叠和进化提供了重要线索。(来源:清华大学)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。