清华大学医学院教授、生命学院兼职教授颜宁领导的研究组在9月的《生物化学期刊》(Journal of Biological Chemistry)上同时发表两篇研究论文“Functional Mechanism of the Abscisic Acid Agonist Pyrabactin”和“Single Amino Acid Alteration between Valine and Isoleucine Determines the Distinct Pyrabactin Selectivity by PYL1 and PYL2”,系统阐述了ABA分子功能类似物Pyrabactin选择性作用于脱落酸受体的分子机制,为设计发展可施用于农业的ABA替代小分子提供了分子基础。
脱落酸(Abscisic acid, ABA)是植物中最为重要的激素之一,它与植物生长发育和抗逆抗旱等生理过程都有极为密切的关系。2009年4月,美国和欧洲的两个研究组独立发现了一类被命名为PYR1/PYL/RCAR的蛋白可能为ABA受体。同年秋,颜宁教授的研究组和美国、日本、欧洲的其他四个研究组分别利用结构生物学和生物化学方法独立证实了这类蛋白就是ABA受体,并且揭示了其作用分子机制。ABA受体的发现与结构生物学鉴定被Science杂志评为2009年度十大突破之一。
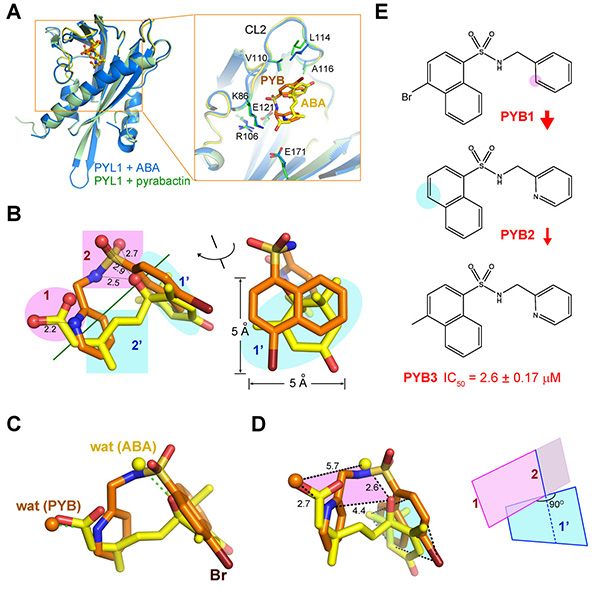
由于ABA在保护植物对抗逆境中的重要作用,ABA在农业中应该有重要的应用价值。然而,由于ABA的不稳定性以及合成ABA的高昂成本,需要开发ABA的功能类似分子以实现农业应用的可能。Pyrabactin是被报道的对PYL蛋白有选择性的ABA类似物,但是pyrabacin的化学结构与ABA十分不同,其工作机制以及对PYL的选择机理都不清楚。颜宁教授的研究组在以前工作的基础上又对小分子Pyrabactin对PYL蛋白的作用机制进行了详细研究。在第一篇
JBC论文中,研究小组解析了 Pyrabactin与受体PYL1的复合物结构,通过与之前解析的ABA结合状态下PYL1复合物结构比较和生化实验,总结出设计ABA类似物时重要功能基团的组织规律,这为设计ABA功能类似化学小分子并应用于农业生产提供了指导作用。在第二篇论文中,研究小组揭示了Pyrabactin分子选择性作用PYLs蛋白家族中几个蛋白的分子机制,他们得到Pyrabactin与受体PYL2的复合物结构,他们发现,非常令人惊讶的是仅仅由于一个氨基酸的变化(VAL to ILE)引起了PYL蛋白对Pyrabactin产生了不同的结合方式,从而决定了pyrabactin的选择性。这项研究显示了植物中PYL介导的ABA受体通路调控的复杂性。(来源:清华大学
学院)
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。