华东师范大学
学院李大力教授团队继2022年10月在国际著名学术期刊 Nature Chemical Biology 报道新一代精准安全的腺嘌呤碱基编辑器ABE9以及11月在国际著名学术期刊 Nature Biotechnology 报道高精度新型胞嘧啶碱基编辑系统Td-BEs后,一年不到又迎来新的技术突破,2023年6月15日该团队再次在 Nature Biotechnology 上发表了题为“Adenine transversion editors enable precise, efficient A·T-to-C·G base editing in mammalian cells and embryos”的研究论文。
该研究报道了一系列新型腺嘌呤颠换编辑工具(AXBEs和ACBEs),并且证明了ACBEs在不同细胞系与小鼠胚胎中的高效性与精确性,其中产生的小鼠疾病模型(A>C平均效率44%-56%)等位基因突变高达100%。AXBEs和ACBEs为多元化的遗传操作和人类第二大类单核苷酸变异(SNVs)的基因治疗提供新的工具。

Nature Biotechnology 刊发华东师大
学院李大力教授团队研究成果
人类的遗传疾病主要由基因突变造成,并且约58%为单碱基突变(SNVs)【1】。目前,不依赖DNA双链断裂和模板参与的单碱基编辑器(baseeditors)是治疗遗传病强有力的基因编辑工具。现有的碱基编辑技术CBEs(C-to-T),CGBEs(C-to-G), GBEs(C-to-G/C-to-A)和ABEs可实现胞嘧啶转换/颠换编辑以及腺嘌呤的转换突变,由于缺少切除肌苷的内源DNA糖苷酶,ABEs的产物纯度可达99%【2-5】。然而,仍有25%的人类单碱基突变遗传疾病需要精准的腺嘌呤颠换编辑(A-to-C或A-to-T)才能纠正,因此开发高效精准的腺嘌呤碱基编辑器具有重要意义。
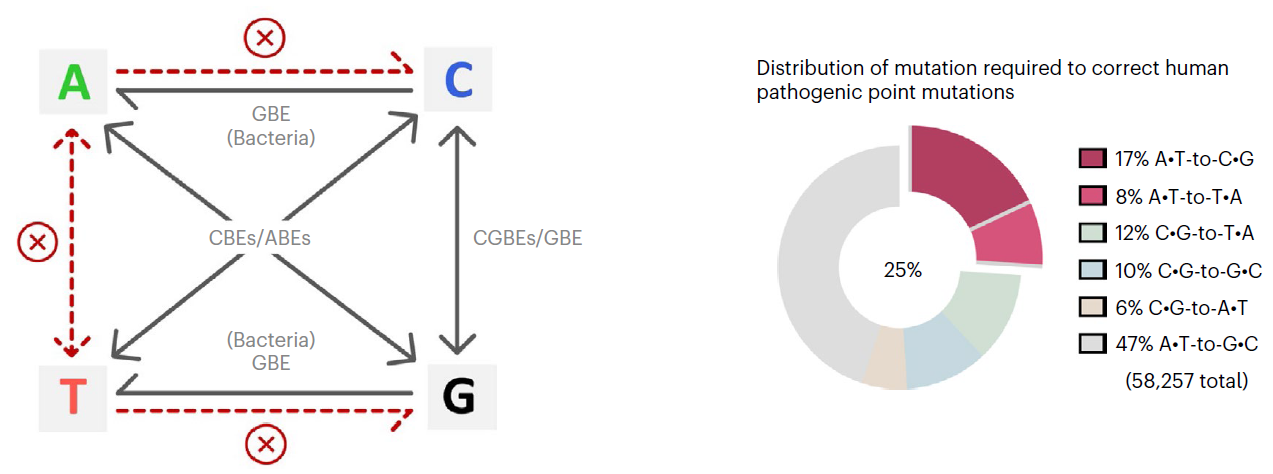
碱基编辑器介导碱基突变的种类及人类致病性点突变的分布
碱基转换可通过碱基脱氨实现,而碱基颠换则需要依赖无嘌呤无嘧啶(AP)位点的创建,随后进行碱基切除修复途径(BER)而完成。鉴于内源糖苷酶低效的肌苷切除修复能力,华东师大研究人员希望寻找其他可将肌苷作为催化底物的酶,在大多数原核和真核生物中,DNA中的次黄嘌呤是由烷基腺嘌呤DNA糖基化酶或者核酸内切酶V去除,因此研究人员尝试将9种体外具有潜在肌苷切除活性的酶与腺苷脱氨酶TadA-8e和nCas9融合,结果惊喜的发现小鼠来源的烷基腺苷DNA糖苷酶(mAAG)可实现8.7%的A到Y(Y=C或T)的碱基颠换,并且大鼠、枯草芽孢杆菌来源的融合构建体也观察到了一定的腺嘌呤颠换突变。进一步的位置关系测试发现mAAG位于构建体C端的编辑活性最高,因此将其命名为AXBE(X代表任意碱基)。
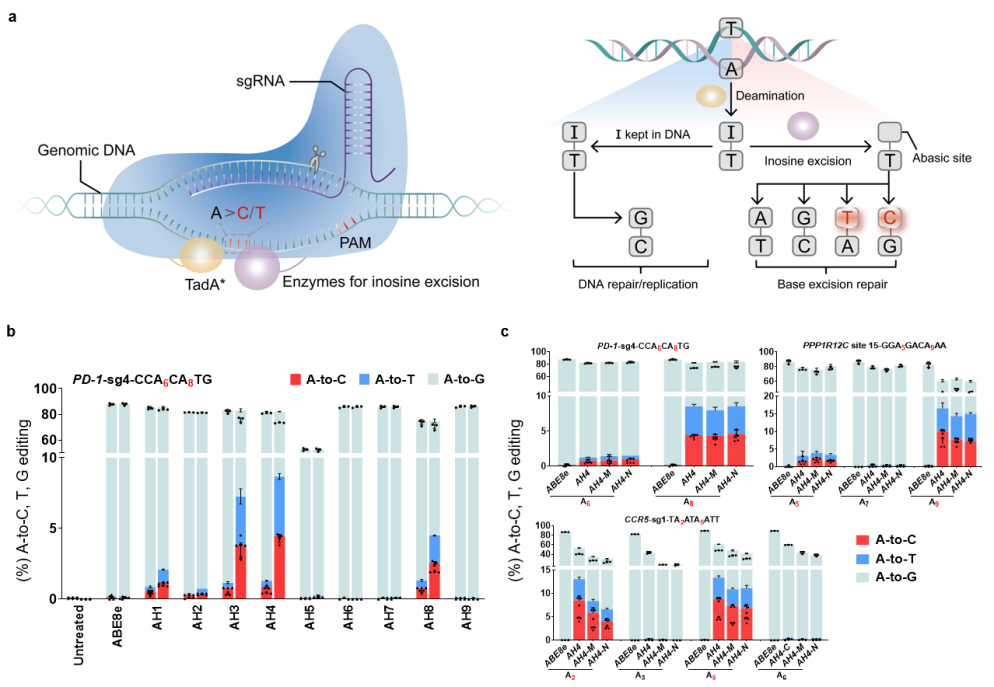
腺嘌呤碱基颠换原理图以及腺嘌呤颠换编辑器候选者筛选
经过大量内源性靶点评价以及体外酶活实验发现AXBE具有YA*R (R=A或G)碱基背景序列(motif)的偏好性。在含有YAR motif的靶点中,AXBE可产生15-32%的A到Y碱基颠换编辑。AXBE在HeLa细胞系中也可达到高达46%的腺嘌呤碱基颠换。通过Cas9依赖性/非依赖性DNA水平脱靶评估以及转录组水平脱靶检测发现,相比于ABE系统,AXBE的脱靶明显降低,尤其是在RNA水平上降低了90%。

AXBE编辑特性的表征
为增加腺嘌呤颠换编辑效率并拓展靶向范围,基于结构导向的理性设计和筛选鉴定出mAAG中的两个关键突变(mAAG-EF)极大提高对其底物肌苷切除的活性,基于此产生的AXBEv2介导更高效的A到Y编辑,甚至在非YAR-motif位点的颠换突变也显著提升,因此有效改善了颠换编辑的序列背景选择性。此外,mAAG-EF也可以兼容PAM识别更广的其他Cas9变体(如spNG, spRY),表明了可以广泛地靶向基因组,扩大应用范围。
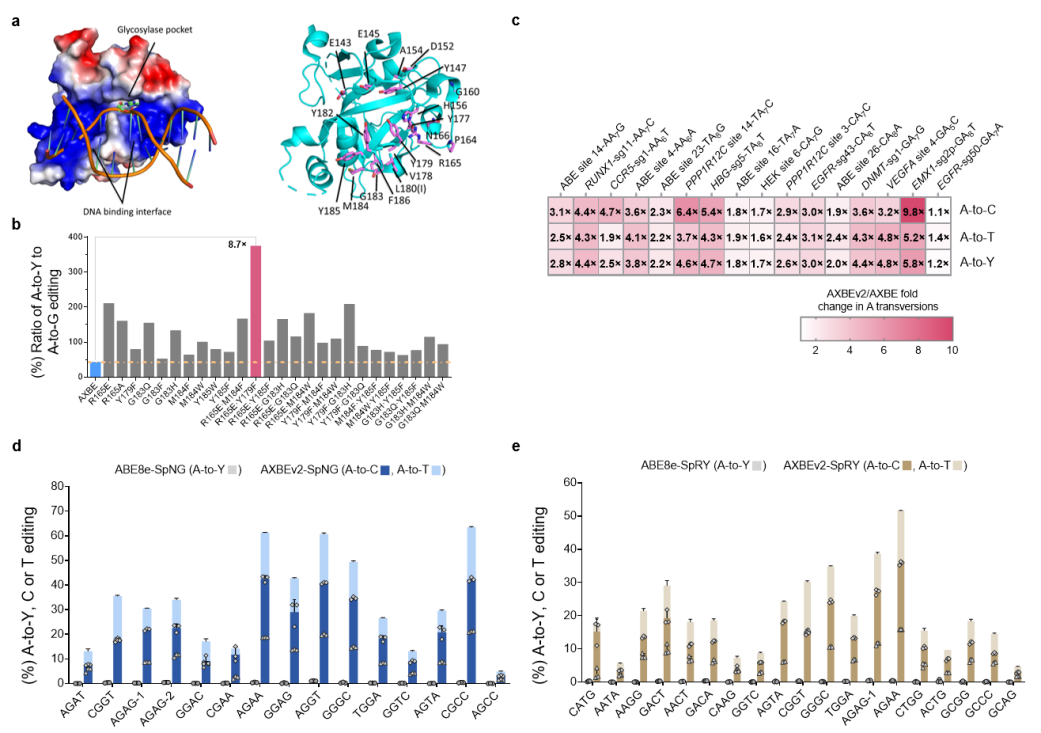
mAAG的分子进化以及AXBEv2编辑特性的表征
虽然AXBEv2展现了高效的A到Y编辑能力(C为主要产物),但也诱导了严重的非目标碱基A到G突变,于是研究人员希望通过缩窄编辑窗口减少不想要的编辑副产物。腺嘌呤脱氨酶的改造及Cas9嵌入策略的尝试使得A到G的编辑副产物大幅降低,并且A到C的编辑效率还进一步提高,因此该类型编辑器被命名为ACBEs。其中ACBE版本最高可实现45%的A到C编辑以及73%的碱基颠换编辑,而ACBE-Q版本(TadA-8e中引入N108Q突变)相较于ACBE,进一步显著减少了旁观者A到G突变,更加精准地编辑sgRNA的A4-A6位,精确度最高提高了171倍,且只产生背景水平的Cas9非依赖性脱靶事件(平均脱靶效率<0.3%),展现出较高的应用安全性。

ACBEs编辑器的开发及表征
此外,ACBE-Q在小鼠体内也展现出极高的编辑效率和精度。在构建杜氏肌营养不良小鼠疾病模型中,70%突变小鼠(21/30只)实现了靶位点A6到C的编辑,平均编辑效率为56%,A>C编辑纯度最高可达到99.8%。更重要的是,传统的终止密码子产生只能依赖于胞嘧啶的突变,该研究证明了ACBEs可在富含AT的序列背景中基于腺嘌呤引入提前成熟的终止子,通过终止Tyr基因表达成功构建了小鼠白化病模型。最后研究人员评估了ACBEs编辑人类致病性SNVs位点的能力,结果表明ACBE在SH3TC2基因中有效产生63%的终止密码子,该基因的终止会导致腓骨肌萎缩症疾病,通过靶向MYO7A基因,ACBE精准产生与耳聋有关的L618R错义突变。为了研究ACBEs的治疗潜力,研究者构建了携带STAT3c.1145G>T(该热点突变引起复发性传染病)突变的稳转细胞系,ACBEs可以在目标位置引入了想要的A到C纠正编辑。
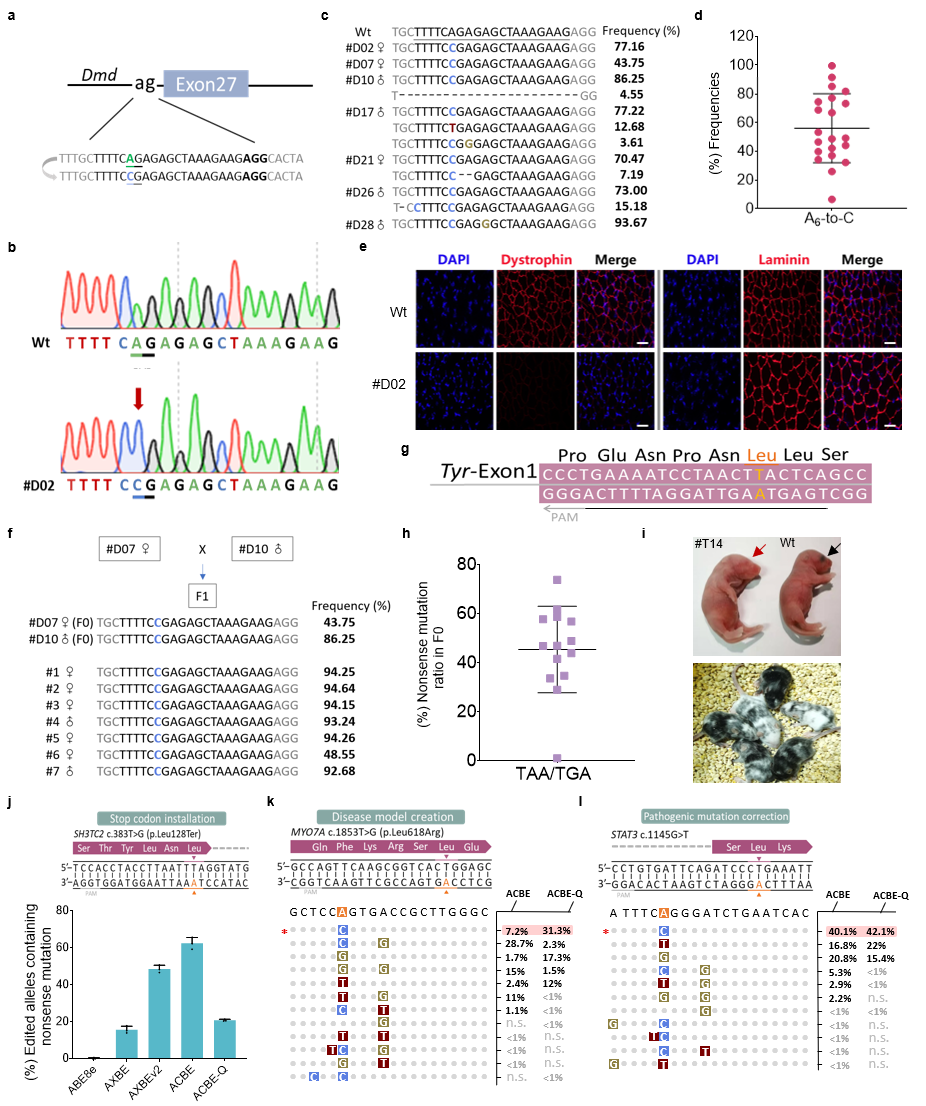
ACBEs在小鼠体内精确编辑以及在细胞系中模拟或纠正人类致病SNVs
总的来说,该研究通过筛选发现融合小鼠来源的烷基腺苷DNA糖苷酶(mAAG)的腺嘌呤颠换编辑器AXBE可在特定序列中实现腺嘌呤的颠换,进一步的分子进化使得A到Y编辑最高可达73%。AXBEs带来丰富的密码子和氨基酸改变,未来将更适用于分子进化、遗传筛选、谱系示踪等应用。ACBEs能够在AT富集区域提前引入终止密码子扩大了基因调控的范围,并且mAAG与不同Cas变体的兼容性有望进一步扩大A到C的靶向范围,表明了纠正人类第二大类致病性SNVs的治疗前景,另外ACBEs还可以作为独特的工具来探索与胸腺嘧啶相对的特定AP位点如何修复的机制。
华东师范大学
学院博士毕业生陈亮、博士研究生洪梦佳和栾昌明为本论文的共同第一作者,华东师范大学为第一单位,华东师范大学
学院李大力教授为本文通讯作者。麻省理工学院-哈佛大学博德研究所David R. Liu教授团队,华东师范大学
学院刘明耀教授及宋高洁研究员、香港中文大学冯波教授等对本项研究提供了重要支持。该研究受到了科技部重点研发计划、国家自然科学基金以及上海市教委前沿科学基地和重大项目等支持。
附:
论文链接:https://www.nature.com/articles/s41587-023-01821-9
参考文献:
[1] Landrum, M.J. et al. ClinVar: public archive of interpretations of clinically relevant variants.Nucleic Acids Res. 2016, 44: D862-868.
[2] Komor AC, Kim YB, Packer MS, et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage.Nature, 2016, 533: 420-424
[3] Koblan LW, Arbab M, Shen MW, et al. Efficient C·G-to-G·C base editors developed using crispri screens, target-library analysis, and machine learning.Nat Biotechnol, 2021, 39: 1414-1425
[4] Zhao D, Li J, Li S, et al. Glycosylase base editors enable c-to-a and c-to-g base changes.Nat Biotechnol, 2021, 39: 35-40
[5] Gaudelli NM, Komor AC, Rees HA, et al. Programmable base editing of A·T to G·C in genomic DNA without DNA cleavage.Nature, 2017, 551:464-471.
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。