6月8日,《自然—植物》在线发表了中国科学院微生物研究所孔照胜团队的最新研究成果。该研究揭示了苜蓿根瘤维管组织传递细胞特异表达的硝酸盐转运体NPF7.6,通过感知环境中硝酸盐浓度变化,介导其吸收与转运,调控豆血红蛋白基因表达来控制一氧化氮稳态及固氮酶活性,从而实现对根瘤发育与共生固氮的精细调控。
氮素是植物生长发育所必需的主要元素。氮肥的使用在增加作物产量中发挥至关重要作用。然而,氮肥的超量使用现象日趋严峻。如何为农作物提供更加廉价、清洁、高效的氮素营养已成为当下迫切需要解决的问题。
生物固氮在地球氮循环与农业生产中具有举足轻重的作用。豆科植物能够与根瘤菌通过互惠共生关系将空气中的氮气转化为供宿主植物直接利用的氮素形式,满足植物生长发育需要。统计数据显示共生固氮每年可向农业系统中提供大约5000万吨氮素营养。因此,有效利用生物固氮对减少农业生产成本、促进农业可持续发展与保护生态环境具有重要意义。
共生固氮是豆科植物为了更好地适应氮素匮乏环境演化而来的,其本身是一个耗能的生物学过程,因此豆科植物会根据环境土壤中的氮素水平,开启或关闭结瘤固氮发育程序。有趣的是,环境土壤中低浓度的氮素会促进结瘤固氮,而高浓度氮素则对结瘤固氮具有抑制作用。
但是,自从1916年Fred和Graul发现氮素对根瘤共生固氮具有调节作用以来,目前人们仍然不清楚豆科植物如何感知环境中氮素浓度变化、进而精准调控结瘤固氮的分子细胞机制。
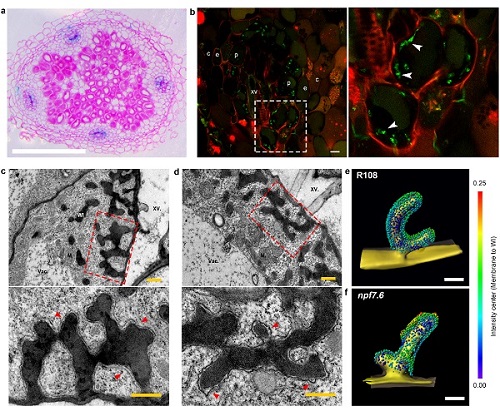
传递细胞是一类具有內向生长细胞壁结构的特化细胞,其主要特点是在细胞中形成许多不规则鹿角状或迷宫状突起。细胞质膜紧贴这种多褶的壁内突物,使细胞的吸收、分泌以及与外界交换物质的面积大大增加。传递细胞富含各种转运蛋白,主要承担各种溶解物质的短途运输功能。
其具体功能主要包括从外界环境中吸收溶质;分泌溶质到外界环境;从周围组织细胞吸收溶质;分泌溶质到周围组织细胞。在植物维管组织以及植物表面发挥分泌功能的组织中常常有传递细胞的分布。
早期研究发现,豆科植物与根瘤菌的共生根瘤维管组织中也存在传递细胞,但其分布规律、三维结构及在共生固氮过程中如何调控营养运输与信号传递的机制尚不清楚。
孔照胜团队的最新研究首次大尺度高分辨解析了根瘤维管系统中传递细胞的分布规律,并重构了传递细胞的内部三维结构:根瘤维管组织中的中柱鞘细胞、靠近木质部导管的薄壁细胞和靠近韧皮部筛分子的薄壁细胞都具有内突生长的细胞壁结构,因此均作为传递细胞发挥功能。传递细胞富含线粒体、内质网和胞间连丝,有利于物质的短距离运输。
如果把根瘤维管系统比作连接根瘤侵染细胞(共生固氮细胞)与宿主根系的主航道,那么传递细胞就相当于中转码头,而各种转运蛋白就是一个个摆渡车,繁忙有序地执行各种复杂的营养物质传递与信息交流任务。
硝酸盐是土壤中最主要的无机氮素营养形式,并可作为重要的信号分子调节植物器官发育。该研究进一步发现蒺藜苜蓿中编码硝酸盐转运体的NPF7.6基因在根瘤维管束中特异表达,NPF7.6蛋白定位在传递细胞的质膜上。NPF7.6基因敲除突变体根瘤维管束发育异常,特别是在传递细胞中存在明显的不规则锯齿状质膜结构。
NPF7.6的表达、定位及功能研究 图片来源:中国科学院微生物研究所
有趣的是,NPF7.6基因受根瘤菌和高浓度硝酸盐诱导表达,提示其调控硝酸盐介导的根瘤共生固氮。爪蟾卵母细胞生理试验表明NPF7.6是一个高亲和性的硝酸盐转运体。更重要的是,与野生型根瘤相比,npf7.6突变体根瘤不能精确感知环境中硝酸盐的浓度变化进而调控根瘤发育。而且通过硝酸盐的模拟吸收试验进一步表明,npf7.6突变体根瘤从苜蓿根系和外界环境吸收15NO3-的能力与野生型相比均显著降低。上述结果表明定位于传递细胞质膜的NPF7.6能够通过介导硝酸盐吸收来调控结瘤及根瘤维管组织的可塑性发育。
进一步研究发现:在无氮条件下,根瘤菌诱导NPF7.6基因表达,根瘤从宿主植物根系中吸收硝酸盐来维持根瘤基本生长;在低硝酸盐浓度下,根瘤菌诱导NPF7.6表达,根瘤吸收外界环境中的硝酸盐,避免了根瘤发育与宿主生长竞争氮源,从而促进根瘤发育;在处于高硝酸盐浓度环境中时,根瘤菌与高浓度硝酸盐同时诱导NPF7.6表达,促进硝酸盐吸收,根瘤中过量的硝酸盐抑制豆血红蛋白基因的表达,扰乱一氧化氮稳态,进而抑制固氮酶活性。
综上所述,该研究解决了豆科植物如何感知环境中硝酸盐浓度变化,进而精细调控根瘤发育及共生固氮这一领域内备受关注的重要科学问题。该研究成果为未来有效利用共生固氮、培育高效固氮植物材料提供了理论依据,同时也对苜蓿这一最重要牧草的分子设计育种具有重要的参考价值。
相关论文信息:https://www.nature.com/articles/s41477-020-0683-6
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。