|
|
|
|
|
通过不对称炔丙基胺化及相关串联反应构建手性α-季碳炔丙胺和氮杂环 |
|
|
近日,华东师范大学周剑和周锋教授团队发展了吡啶C4位大位阻功能基和噁唑啉C5位手性传递基团修饰的空间受限PYBOX配体,在此基础上实现了简单酮衍生手性炔丙醇酯与伯胺或仲胺的不对称ACPA反应。
2024年3月19日,这一研究成果以“Enantioselective propargylic amination and related tandem sequences to α-tertiary ethynylamines and azacycles”为题,发表在Nature Chemistry期刊上。华东师范大学周剑教授和周锋教授,四川大学王欣教授为通讯作者。博士研究生张正为第一作者。
精准合成离不开“远程手性控制”。不对称催化是获得手性化合物的最高效方法。通常,要实现优秀的对映选择性需要反应的潜手性位置能被催化剂的手性诱导直接影响。然而,很多时候催化剂的手性控制却远离要新形成手性的位置,需要进行远程手性控制。比如,去对称化是发展不对称催化反应的主要策略之一,其特点是反应并不发生在潜手性位置,需要远程手性控制。通过远程控制来构建手性季碳这类拥挤化学空间时,挑战性更大,因为要远程识别潜手性碳上取代基的微小差异性来实现选择性控制对手性催化剂的要求更高,这一点参见周剑和周锋团队近期的邀请综述(Nature Synthesis 2023, 2, 1020-1036)。
铜催化的不对称炔丙基胺化反应(ACPA)是需远程手性控制的另一类反应,因为现场生成的亚丙二烯基铜中间体的潜手性中心距离金属有三根化学键,而通常的酮或酮亚胺等被金属活化时潜手性中心距离金属仅两个化学键。自Maarseveen和Nishibayashi首次报道以来,该反应作为构建乙炔基取代α-手性胺的重要方法得到广泛研究。由于具有手性季碳作为优势骨架在药物研发的重要应用日益显现,利用ACPA来合成手性α-季碳炔丙胺引起了广泛关注。目前,使用兼具芳基和含氧取代基的炔丙基叔醇衍生物已发展了系列高对映选择性方法,但基于普通脂肪或芳香酮的炔丙基叔醇衍生物依然是挑战性底物,因为其产生的全取代亚丙二烯基铜中间体的潜手性碳上的取代基差异性很小,很难被双铜催化中心进行有效远程手性控制。
周剑和周锋团队在发展不对称铜催化的炔烃和叠氮的环加成反应(CuAAC)时,通过在吡啶双噁唑啉配体(PYBOX)的吡啶C4位引入烷氧基、膦酸酯基和砜基等大位阻功能基,发展了一系列电性和位阻效应迥乎不同的手性PYBOX配体,实现了系列高对映选择性不对称CuAAc反应(Org. Lett. 2020, 22, 1270; Angew. Chem. Int. Ed. 2021, 60, 8488; 2023, e202301470)。特别是具有大位阻烷氧基的PYBOX配体可在间隔4个化学键时,以优异对映选择性实现远程去对称化构建磷手性(Chem. Sci. 2020, 11, 97)。鉴于CuAAC和ACPA均被认为涉及双铜催化,因此利用所发展的各种具有C4 位大位阻取代的PYBOX 配体,来尝试4-苯基2-丁酮衍生的炔丙醇酯与苯胺的反应,但均未取得理想结果。
分析原因,认为仅靠配体手性中心的取代基和吡啶C4位大位阻功能基难以形成手性深腔,因此设计在噁唑啉C5位引入手性传递基团来加强噁唑啉手性中心的取代基与吡啶C4位大位阻功能基之间的协作,增强双铜络合物的远程手性识别能力。根据这一设计,发展了(1S,2R)-1,2-二苯基氨基醇衍生的PYBOX配体,其噁唑啉环C4和C5的双苯基和吡啶C4位的苄氧基可以形成高度受限的空间,从而以最高88%产率和88%ee得到目标产物。最终通过降低反应温度和增加碱的用量,可以取得82%产率和92% ee值。随后,针对苯乙酮衍生炔丙醇酯的ACPA反应进行研究,适当调整PYBOX吡啶C4位苄氧类型及铜盐等反应条件,最终能够取得95%的产率和94%的ee值。
所发展的ACPA反应具有宽泛的底物适用范围。首先对脂肪族炔丙醇酯进行考察,发现对于α-苯乙基类底物,苯环上取代基的电性和位阻对反应没有显著影响;将苯基更换为2-萘基、3-吲哚基、2-呋喃基以及烯基等取代基时,反应均能顺利进行;环己基、哌啶、四氢吡喃取代的底物也能很好兼容;除甲基酮外,其他烷基酮衍生的炔丙醇酯也能取得令人满意的结果。对胺化试剂考察发现苯胺和杂芳胺类伯胺均可取得优秀的对映选择性;此外,异吲哚啉等二烷基胺同样可以兼容,以良好到优秀的对映选择性得到手性α-三取代α-叔胺,该类化合物的不对称催化合成仍然是一个挑战。随后进一步对α-芳基取代炔丙醇酯的反应进行考察,对于苯乙酮,氟甲基苯乙酮衍生的底物均能很好地兼容;除普通苯胺外,一些药物分子衍生的芳胺也可顺利参与反应得到相应的手性胺类化合物。
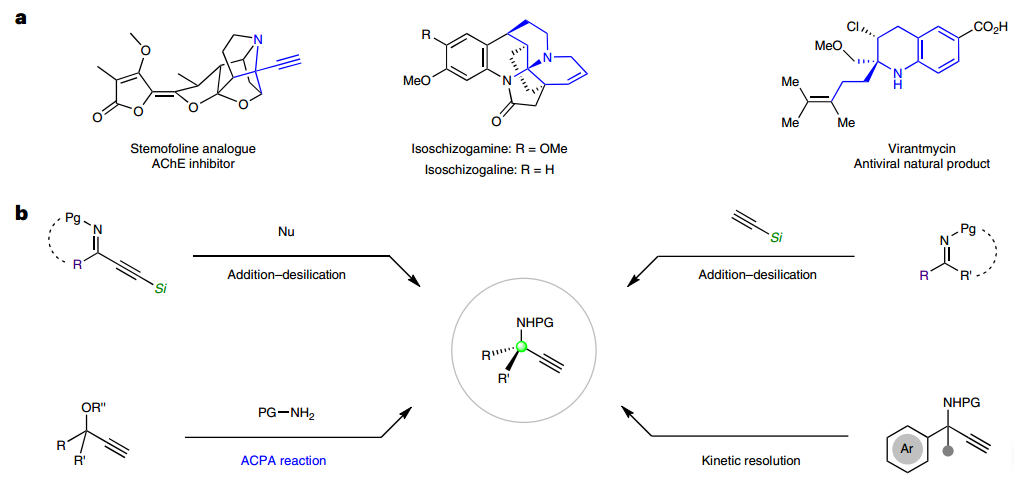
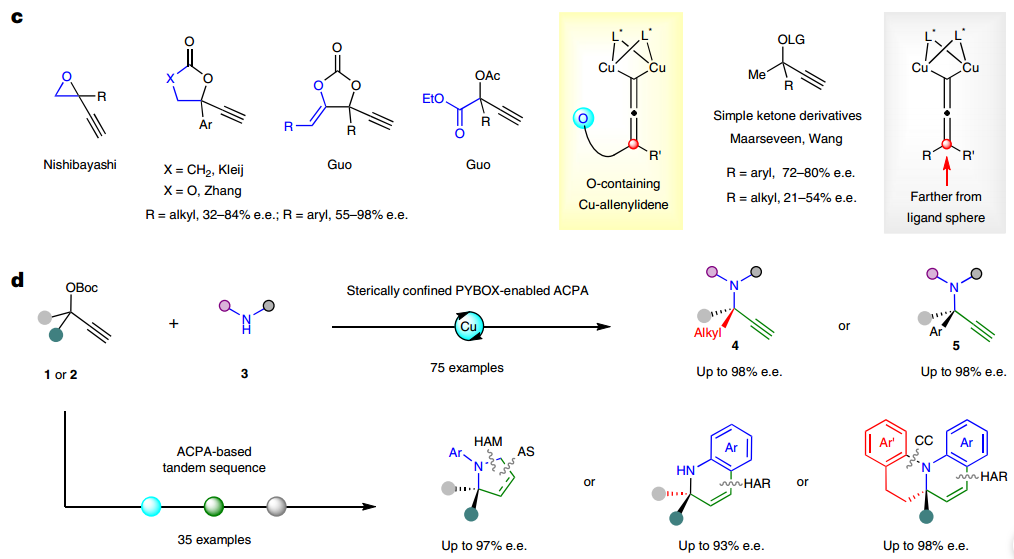
图1:基于ACPA的手性α-叔炔丙胺。
所得手性α-季碳炔丙胺中含乙炔基和胺基等官能团,进而可以作为平台分子多样性构建手性氮杂环类化合物。基于此,作者将发展的不对称ACPA反应与铜催化端炔联烯基化、氢胺化、金催化氢芳基化以及钯催化偶联反应相结合,发展了系列不对称催化串联反应,分别实现了含α-氮杂季碳中心的手性二氢吡咯、四氢吡咯、二氢喹啉、二氢苯并喹啉和四氢喹啉类化合物的一锅法高效、高立体选择性合成。
随后,作者利用所发展的ACPA反应作为关键步骤,以9步13%的总产率实现了β-分泌酶(BACE-1)抑制剂的不对称催化全合成,已有文献方法需要手性拆分且8步仅能取得5.6%的总产率。此外,所得α-季碳炔丙胺中的乙炔基可进行多样性转化,进一步实现了α-位含不同取代基的手性叔胺的多样性合成。
为了深入研究反应机制,作者进行了系列对照实验。首先,通过非线性效应实验,以及对配体和铜盐比例的考察,表明反应过程可能形成双核铜-双PYBOX配合物;随后对反应体系进行紫外-可见光谱分析,表明真正的催化物种可能是Cu(I)配合物;进一步通过核磁研究,表明碱的存在会加速亚丙二烯基铜中间体的形成。为解释所发展的空间受限PYBOX能够取得高对映选择性的原因,与四川大学王欣教授合作进行了理论计算研究。结果表明吡啶C4位苄氧基和噁唑啉上手性传导基团的引入,可以形成空间更为受限的过渡态,进而使得底物和配体间π-π相互作用和空间排斥作用更为显著,从而取得更好的立体选择性控制。
此外,为了拓展此类空间受限的PYBOX配体的适用性,作者对α-CF3取代炔丙醇酯分别与苯甲醛肟氧亲核试剂和4-羟基香豆素碳亲核试剂的不对称炔丙基取代反应进行了初步尝试,均能取得良好的对映选择性,且所发展的空间受限PYBOX配体的立体选择性控制能力明显优于未修饰的PYBOX L5。
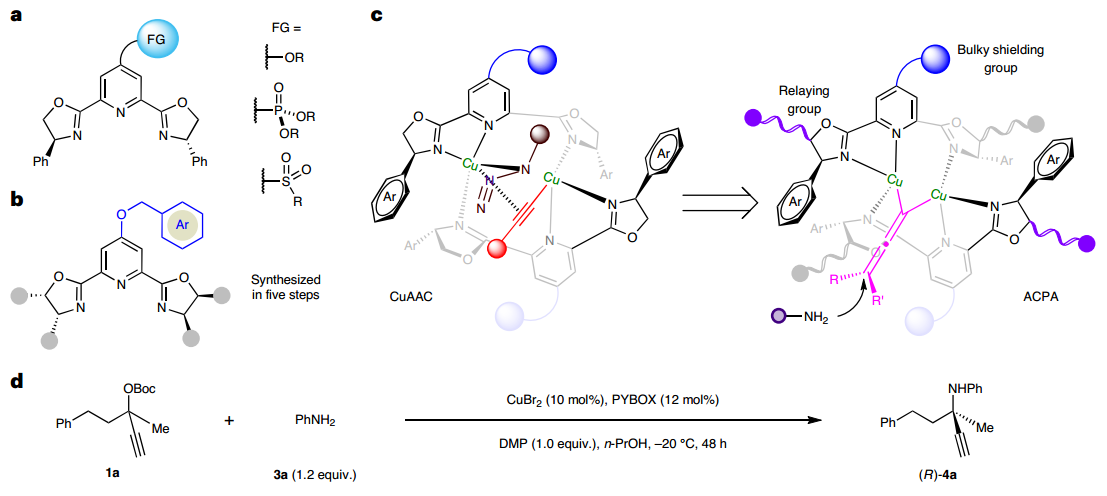
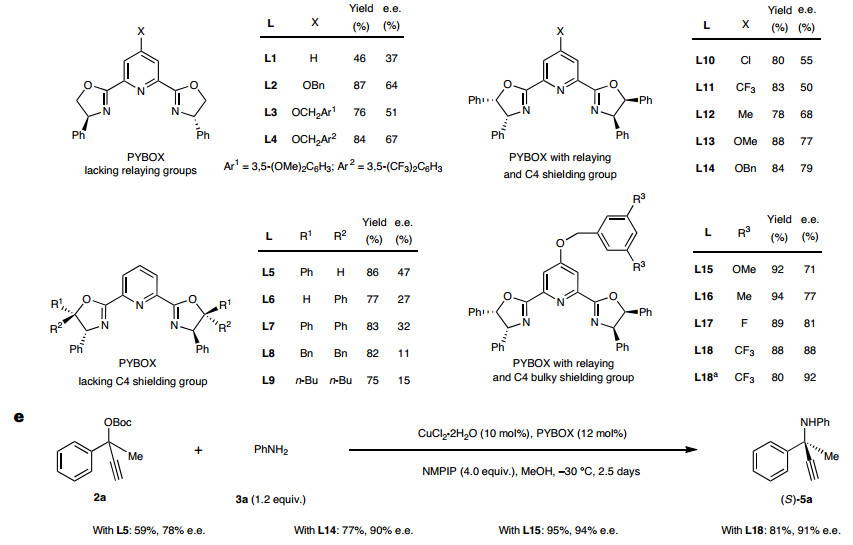
图2:手性空间受限PYBOX配体的设计与应用。
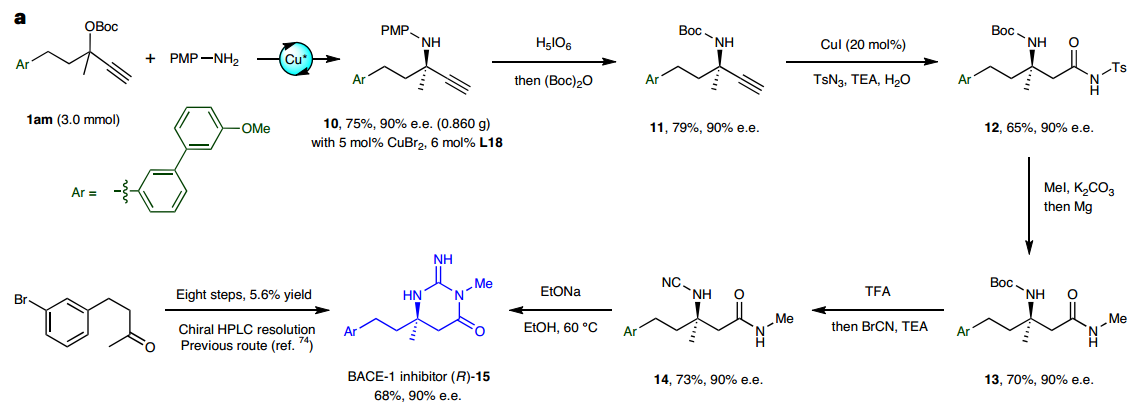
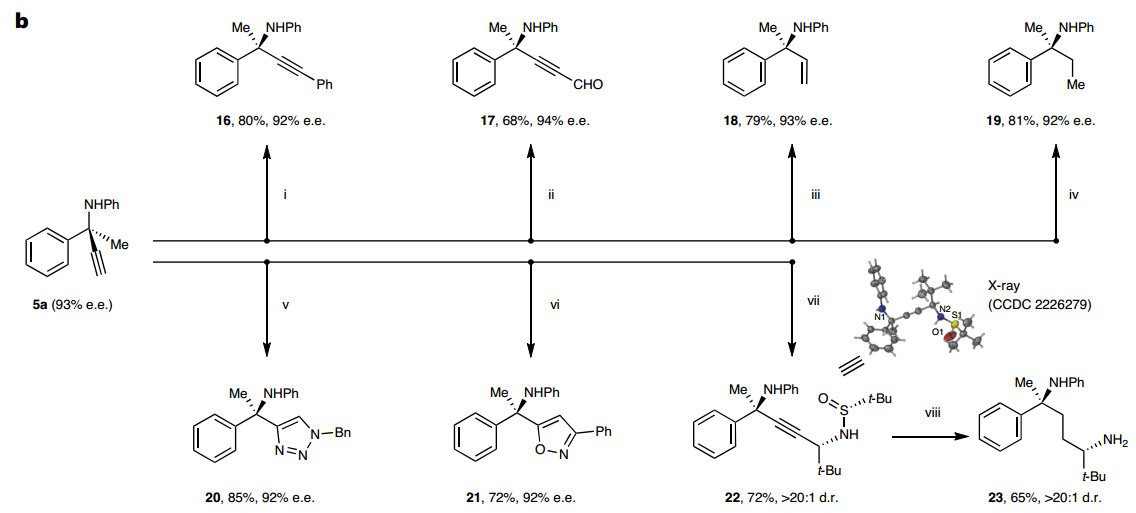
图3:合成应用。
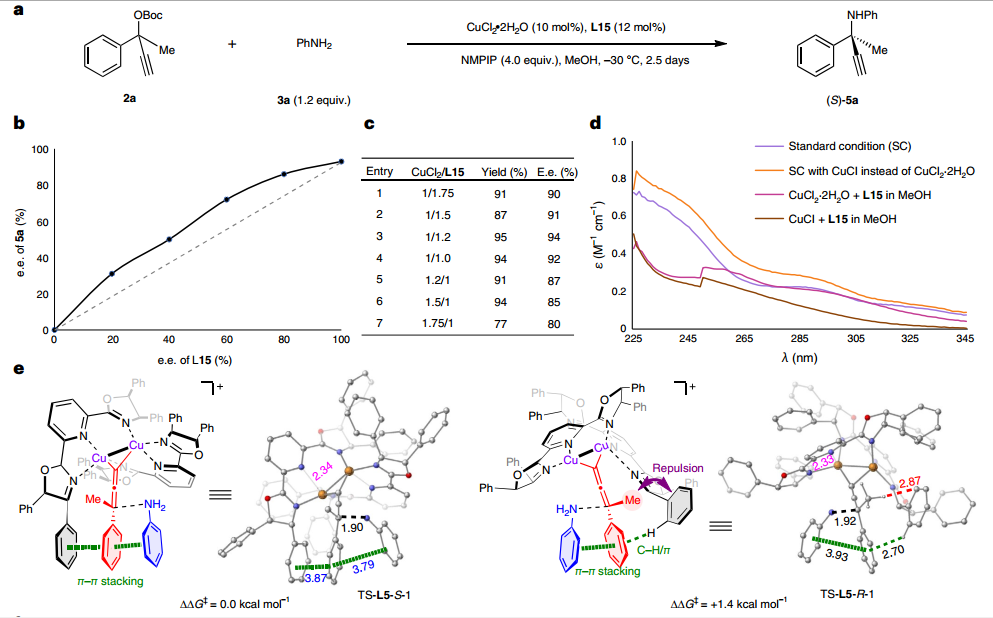
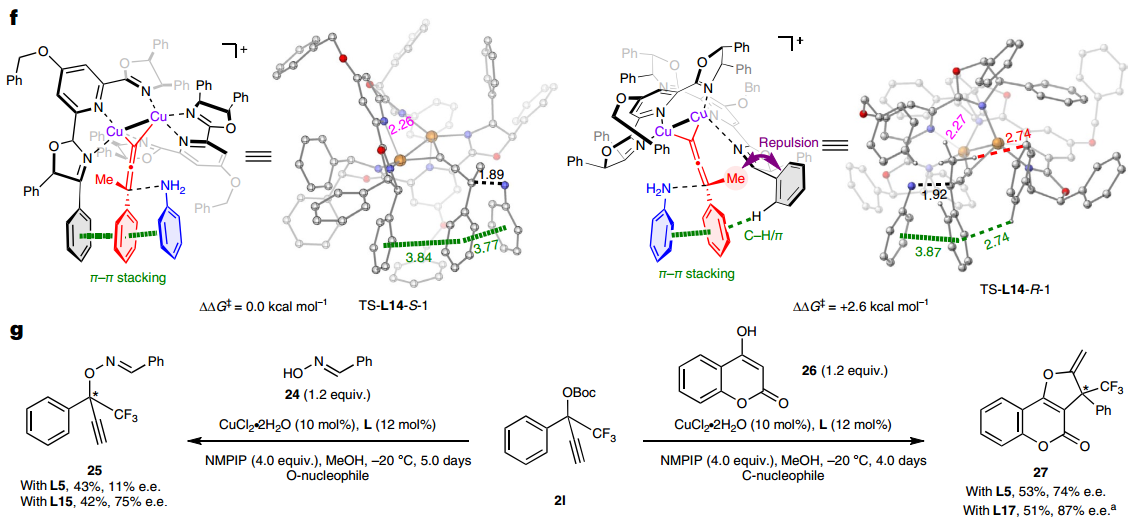
图4:机理研究和进一步应用。
综上所述,周剑和周锋教授团队发展了兼具大位阻功能基和手性传导基的空间受限的PYBOX配体,在此基础上实现了高底物普适性和高对映选择性的简单酮衍生手性炔丙醇酯与伯胺或仲胺的不对称ACPA反应,进而发展了基于ACPA的不对称催化串联反应,为多种具有氮杂季碳的手性含氮杂环化合物的多样性高效合成提供了一种新途径。此外,实现了β-分泌酶抑制剂的首次不对称催化全合成以及多种手性胺类化合物的衍生化。机理研究表明吡啶C4位取代基与噁唑啉环上手性传递基团的协同作用,利于实现远程手性控制。对于氧亲核和碳亲核试剂参与的不对称炔丙基取代反应同样表现出更为优秀的对映选择性控制。
上述研究工作得到了国家自然科学基金委(21725203,21971067,21871090),上海市科技创新行动计划(No.20JC1416900),上海市教委创新计划(2023ZKZD37)和中央高校基本科研业务费的财政支持。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-024-01479-z