构成生命的天然核酸和天然蛋白质均具有手性单一特性:已知的天然核酸都由D型核糖组成,天然蛋白质几乎都由L型氨基酸组成。朱听教授课题组致力于从遗传信息中心法则出发,利用化学、生物学等多学科手段构建与天然生物分子手性相反的“镜像生物学系统”。至今,朱听教授课题组已初步实现了镜像中心法则中的镜像核酸复制、转录、逆转录等过程,突破了大型镜像蛋白质全化学合成和千碱基长度镜像基因合成、镜像RNA转录的技术瓶颈,开发了镜像核酸测序、镜像DNA信息存储、镜像核酸定向进化等技术,目前正在着力构建镜像蛋白质翻译系统以实现完整的镜像中心法则,并尝试拓展镜像生物学系统的实际应用。
由于镜像多肽和镜像蛋白质无法被天然蛋白酶降解,传统的基于天然蛋白酶降解及液相色谱–串联质谱(LC–MS/MS)的方法无法直接应用于镜像多肽和镜像蛋白质测序。2024年1月18日,朱听教授课题组在Nature Chemistry期刊上发表论文“Mirror-image trypsin digestion and sequencing of D-proteins”(利用镜像胰蛋白酶实现镜像蛋白质的降解与测序)。研究者全化学合成了镜像胰蛋白酶,并利用该镜像蛋白酶降解、测序了多种镜像蛋白质,包括镜像核糖体蛋白质L25、镜像DNA聚合酶Dpo4及其Y12S突变体,并开发了基于长链镜像多肽的信息存储技术。
胰蛋白酶可催化位于赖氨酸或精氨酸残基C端的肽键水解,而可降解的蛋白质也包括胰蛋白酶自身。为避免镜像胰蛋白酶复性时自身降解,研究者选择首先全化学合成不具有酶活性的镜像胰蛋白酶原。研究者将全长为231个氨基酸的猪胰蛋白酶原分为五段进行固相多肽合成和自然化学连接,并通过复性得到正确折叠的酶原,然后利用胰蛋白酶原的自我激活获得具有完整酶活性的镜像胰蛋白酶(图1)。

图1:合成镜像胰蛋白酶
在此基础上,研究者使用镜像胰蛋白酶降解了镜像核糖体蛋白质L25和镜像Dpo4,并使用液相色谱–串联质谱对两种蛋白质分别进行序列鉴定。研究者发现两种镜像蛋白质的序列覆盖度(sequence coverage)达99%(图2)。同时,研究者还比较了镜像Dpo4与其Y12S突变体,根据质谱分析结果准确辨别出这两种不同版本的镜像蛋白质。
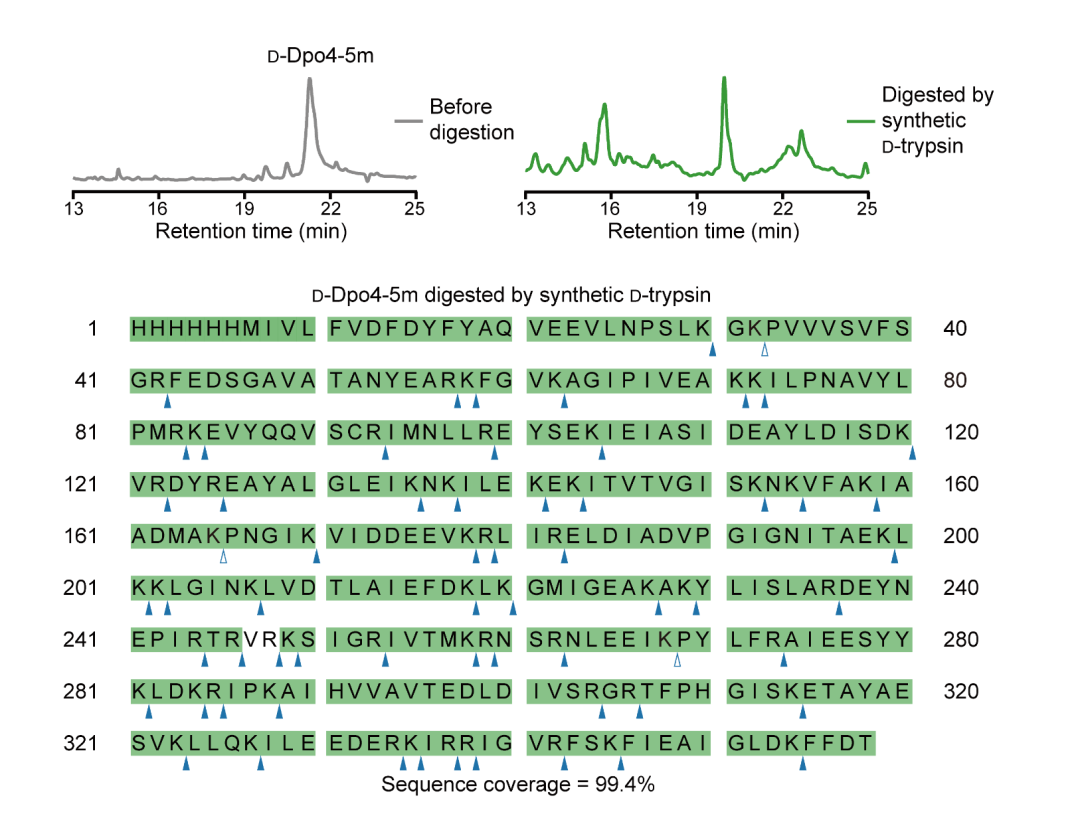
图2:利用镜像胰蛋白酶对镜像Dpo4进行降解与测序
镜像胰蛋白酶还能增加被测序的镜像多肽长度,使得其作为信息存储介质时存储更多的信息。研究者将文字信息“Mirror-image biology”编码、存储进一条长为50个氨基酸的镜像多肽中,利用镜像胰蛋白酶将其降解,使用液相色谱–串联质谱成功读取出该镜像多肽的序列,并将其解码得到原文本信息:“Mirror-image biology”(图3)。
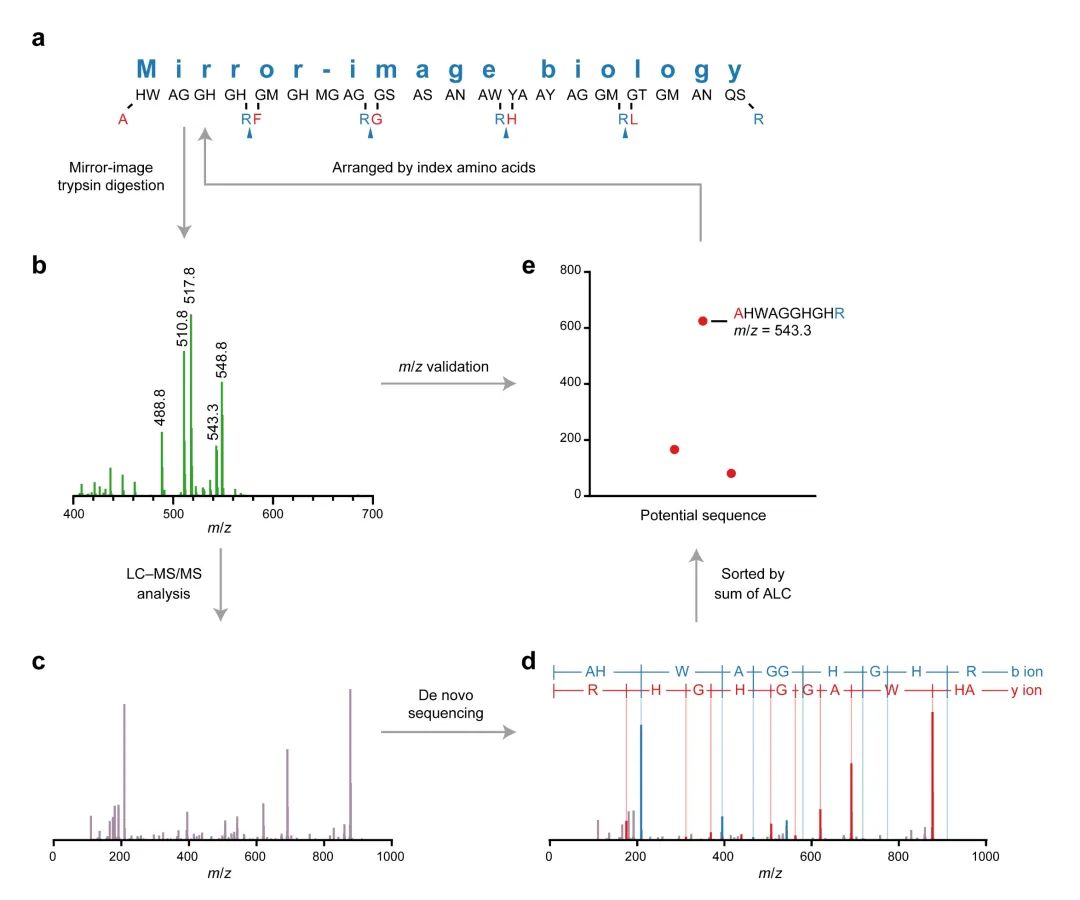
图3:镜像长链多肽信息存储
综上,该研究报道了利用全化学合成的镜像胰蛋白酶实现了镜像多肽和镜像蛋白质的降解与测序。该技术有望被应用于药物开发、信息存储、环境保护等领域。研究者用化学合成方法制备的天然胰蛋白酶,还可成为除动物内脏提取法及工业发酵法之外的天然胰蛋白酶制备新方法,有望从源头上避免引入其他蛋白质污染,为蛋白质组学等相关研究提供更高纯度的天然胰蛋白酶。
清华大学
学院博士生、西湖大学访问学生张冠伟为该论文第一作者,西湖大学
学院朱听教授为通讯作者。(来源:科学网)
相关论文信息:https://dx.doi.org/10.1038/s41557-023-01411-x