2023年12月6日,南方科技大学刘心元团队在Nature Chemistry期刊上发表了一篇题为“A general copper-catalysed enantioconvergent C(sp3)–S cross-coupling via biomimetic radical homolytic substitution”的研究成果。
该成果报道了一种利用铜/手性阴离子单电子转移催化剂,首次成功实现了铜催化的立体汇聚式自由基碳–硫交叉偶联反应,构建了结构丰富多样的手性α-烷基硫化合物。论文通讯作者是刘心元教授;论文共同第一作者是田宇、李锡涛、刘吉人、程健和高昂。
手性α-烷基硫化合物是有机合成和生化反应中非常重要的合成砌块,也是构建生物大分子、药物和农药的核心结构单元。因而,发展不对称催化高效构建手性碳–硫键是现代合成化学和生物学中一个十分重要的研究方向。其中,过渡金属催化含硫亲核试剂参与的不对称碳–硫键构建一直备受化学家的关注,但由于金属–硫键异裂困难(金属–硫键异裂键能高,图1a),反应机理多为硫亲核试剂对手性金属物种的球外进攻来构筑碳–硫键,限制了离子型反应类型的发展。因此,亟需发展新颖催化体系来构建结构丰富多样的手性α-烷基硫化合物。在自然界中,天然酶催化通过自由基均裂取代(金属–硫键均裂键能低)的反应机理来合成生物体内重要的手性含硫生物活性分子(图1b)。这种独特的反应机制催化效率高、立体选择性好,有待于化学家们借鉴从而设计均相手性催化剂来构建手性碳–硫键。
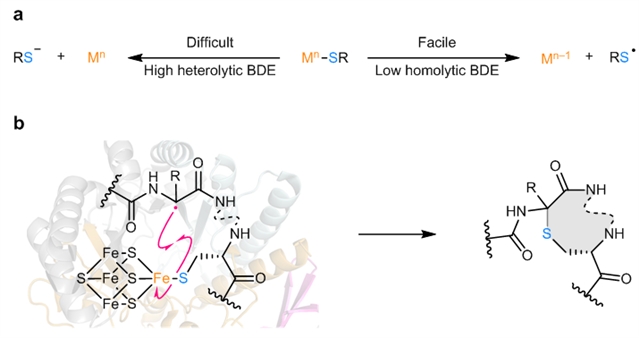
图1:研究背景。
在这项工作中,刘心元团队设想通过模拟天然酶催化自由基均裂取代的反应机理(图2a),同时设计对过渡金属具有较强螯合能力的手性多齿阴离子配体,不仅可以解决硫负离子毒化铜催化剂而且可以克服金属–硫键异裂困难的问题,同时抑制非手性背景反应,从而实现立体汇聚式自由基碳–硫交叉偶联反应(图2b)。基于此设想,刘心元团队使用卤代烷烃作为亲电试剂,在多齿手性阴离子和硫亲核试剂形成的一价铜物种具有足够的还原性下,活化卤代烷烃产生烷基自由基中间体和二价铜,最后烷基自由基与二价铜–硫物种相互作用,通过自由基均裂取代的反应机理实现了铜催化的立体汇聚式碳–硫交叉偶联反应。该反应的底物适用范围十分宽泛,可以兼容不同类型的外消旋苄溴/氯、炔丙基溴、三级α-氯代酰胺和易于转化的硫亲核试剂(硫代磺酸钠和硫代羧酸钾),并展现出良好的官能团耐受性(图2c)。更重要的是,该策略提供了一个灵活且实用的平台来制备结构丰富多样的手性α-烷基硫化合物,产物经过简单的转化可以得到手性硫醇、硫醚、二硫醚、多氟硫烷、亚砜、砜、亚砜亚胺、磺酰胺和磺酰氟等(图2d)。此外,利用该反应作为关键步骤,可以实现对药物分子的后期修饰。该反应的实现为强配位性杂原子亲核试剂参与的立体汇聚式自由基碳–杂交叉偶联反应提供了新策略和新思路。
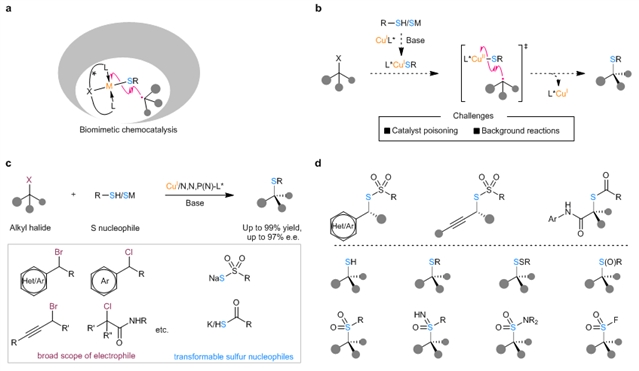
图2:反应设计理念、底物范围和应用转化。
机理研究发现,只有一价铜、硫亲核试剂和手性配体同时存在时,才能形成还原能力较强的手性配体螯合的铜硫亲核试剂活性物种,将外消旋卤代烷烃单电子还原为烷基自由基,进而参与后续的转化得到目标手性碳–硫偶联产物(图3a,3b)。将反应在不同时间淬灭,没有观察到回收溴代烷烃的对映体富集现象,排除反应经历动力学拆分的过程;随着反应的进行,产物的ee值是恒定的,表明反应经历统一的立体汇聚式转化历程(图3c)。当向反应体系中加入自由基捕获试剂TEMPO时,主反应被明显抑制,同时可以分离到TEMPO捕捉到烷基自由基的产物(图3d);自由基钟实验进一步证实了反应体系有烷基自由基中间体的产生(图3e),这表明反应经历了自由基历程。为了进一步揭示反应机理,作者与浙江大学洪鑫团队合作,通过DFT计算对碳–硫成键的机理进行了深入的研究,理论计算表明,碳–硫成键经历了自由基均裂取代的历程。
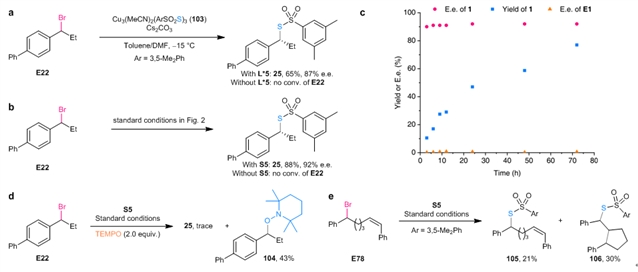
图3:机理研究实验。
作者通过模拟酶催化自由基均裂取代的反应机理,利用铜/手性阴离子单电子转移催化剂,首次成功实现了铜催化的立体汇聚式碳–硫交叉偶联反应。该研究为立体汇聚式自由基碳–杂交叉偶联反应提供了可行策略和新思路。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-023-01385-w