|
|
| FMD | 前沿睿见:不寻常的全球猴痘暴发——我们应该做什么? |
|
论文标题:Unusual global outbreak of monkeypox: what should we do?
期刊:Frontiers of Medicine
作者:Miaojin Zhu, Jia Ji, Danrong Shi, Xiangyun Lu, Baohong Wang, Nanping Wu, Jie Wu, Hangping Yao, Lanjuan Li
发表时间:13 Jul 2022
DOI:10.1007/s11684-022-0952-z
微信链接:点击此处阅读微信文章

导 读浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟、姚航平团队在Frontiers of Medicine 发表综述《不寻常的全球猴痘暴发:我们应该做什么?》(Unusual global outbreak of monkeypox: what should we do? )。
摘 要近期,COVID-19仍在全球大流行之际,猴痘又成为全球关注的焦点。猴痘是一种由猴痘病毒引起的急性出疹性人畜共患病,以往主要发生在非洲地区。此次猴痘病例不同寻常地在多个非流行国家或地区暴发,而且有人际传播倾向,值得我们重新审视,以防止猴痘疫情的进一步扩散。在这篇综述中,我们全面总结了关于猴痘的相关研究,包括其流行病学、生物学特征、发病机制和临床特征以及治疗方法和疫苗,强调其不寻常的爆发归因于传播方式的转变。我们还就当前疫情形势分析,从临床和科研两方面提出了应对措施。
关键词猴痘;痘病毒;疫苗;传染病
引 言
近期,多个国家报告了猴痘病毒(MPXV)在人与人之间的传播病例,这种情况在以前被认为是极其罕见的。猴痘在短短一个月内从非洲传播到世界各国,根据美国疾病控制和预防中心(CDC)的数据,截至2022年7月8日,全球已有50多个国家和地区共报告了8000多例猴痘确诊病例,其中大多数病例来自欧洲[1]。由于过往仅在少数几个国家出现人类猴痘病例,许多国家疾病监测机制有限且缺乏早期临床识别,因此实际病例数可能有所低估。
正痘病毒家族中仅天花病毒(VARV)、牛痘病毒(CPXV)、痘苗病毒(VACV)和MPXV四种病毒可引起人类感染[2]。MPXV和VARV是 “近亲”,是具有潜在生物恐怖主义威胁的两种重要病原体[3]。天花病毒曾经是一种常见的严重传染病病原体,具有高度的致病性(死亡率约30%)和传播性,在人类历史上肆虐了3000多年,对人类造成了毁灭性打击[4,5]。1980年世界卫生组织(WHO)宣布人类成功在全球范围内消灭了天花病毒后[6],各国陆续停止了天花疫苗的接种。
猴痘被认为是自天花根除以来人类最重要的正痘病毒感染。自1970年首例人类猴痘病例被发现到本次猴痘疫情暴发前[7],猴痘在中非和西非以外的地区很少出现。通过基因组测序,已经确定了猴痘病毒的两个系统发育上的不同分支:中非(刚果盆地)分支和西非分支。通常情况下,中非猴痘病毒与更严重的疾病、更高的死亡率和更频繁的人际传播有关。目前在非洲以外地区暴发的猴痘病毒感染病例,已被证实属于西非分支。此前,猴痘病毒传染性并不高,20世纪80年代的基本繁殖数(R0)低于1[8],而这次暴发前的一项研究显示猴痘R0已高于1[9],而SARS-CoV-2 奥密克戎毒株的平均R0为9.5(2021年11月1日至2022年2月9日)[10]。这种不寻常的暴发要求我们亟需对猴痘进行重新评估。
在此,我们回顾总结了关于猴痘的相关研究,包括其流行病学、生物学特征、发病机制和临床特征,以及治疗方法和疫苗,强调其不寻常的暴发归因于传播方式的转变。我们还就当前疫情形势分析,从临床和科研两方面提出了应对措施。
流行病学
MPXV于1958年在圈养猴子的水疱病暴发中被首次发现,因而被称为“猴痘”[11]。然而猴痘病毒最大的动物宿主并不是猴子,而是松鼠、袋鼠等啮齿动物。啮齿动物作为最大的哺乳动物群,有近1500多种。迄今为止,已在松鼠、大鼠、条纹小鼠、睡鼠和猴子等多种动物物种中检测到MPXV[12-14]。与猴子一样,人类也被认为是MPXV的宿主之一,但目前病毒从动物到人类的传播方式仍不清楚。气溶胶传播方式已在动物身上得到证实[15,16],这可能解释了中非共和国的院内暴发[17]。猴痘病毒通过与病灶、体液、呼吸道飞沫和被污染的材料(如床上用品)密切接触在人际传播。1970年8月,在扎伊尔(今刚果民主共和国)布肯达村的一名9岁儿童被发现患有类似天花的水疱性皮肤病,这是人类报告的首例猴痘病例[18]。猴痘的潜伏期通常为6-13天,但也可以在5-21天不等[19,20]。
猴痘自60年前被发现以来一直没有受到太多关注,但近年来人类猴痘病例的发生频率和地域分布不断增加。近20年来,人类感染猴痘病例数呈指数级增长,超过了首次发现猴痘后前45年的累计病例数[19,20]。贫困和持续的内乱迫使人们猎杀小型哺乳动物(丛林肉)以获得富含蛋白质的食物,从而增加与可能携带猴痘病毒的野生啮齿动物接触的机会[21]。猴痘自发现以来主要在中非和西非呈地方性流行,仅有零星病例报道当地野生动物在人类中传播猴痘。有学者认为,中非和西非的人类猴痘病例不断增加是20世纪80年代初天花疫苗停止接种后人群交叉保护免疫力减弱的结果[20]。此外,美国、英国、以色列和新加坡等非流行地区也报告了多起人类感染病例[22],这些非流行地区的零星暴发与输入啮齿动物或有流行地区旅行史的人有关。
2022年5月,世界多个非流行国家报告了多起猴痘病例,所有病例都没有猴痘流行地区的旅行史,且不同国家报告的病例之间没有流行病学联系。各国向世界卫生组织通报的初始病例的早期流行病学表明,病例主要发生在男男性行为者中[23]。目前,正在进一步研究了解此次猴痘暴发的流行病学、感染源和传播方式。猴痘在几个非流行国家的突然出现表明其可能存在一段未被发现的传播期以及近期的扩散事件。
生物学特征
猴痘病毒属于痘病毒科正痘病毒属,是所有动物病毒中最大和最复杂的DNA病毒之一[24]。猴痘病毒大小为200-300 nm,呈圆角砖状或卵圆形,外周为由不规则形状小管组成的30 nm的外膜。猴痘病毒存在两种不同形式的感染性病毒颗粒:细胞内的成熟病毒(MVs)和细胞外的包膜病毒(EVs)。EVs较MVs有一个额外的包膜。病毒颗粒的内部由一个哑铃状的核和一对位于凹陷和外膜之间的侧体组成(图1)。最近,研究人员预测了多个猴痘病毒变体的全蛋白质组的结构以及小分子结合区域[25]。猴痘病毒含有可溶性抗原、核蛋白抗原和红细胞凝集素,与其他三种感染人类的正痘病毒具有交叉免疫原性。猴痘病毒与其他正痘病毒具有共同的结构抗原和可溶性抗原,在补体结合试验和琼脂扩散试验中,很难与天花病毒和痘病毒区分。
猴痘病毒的基因组为约197 kb的两端共价闭合的线性双链DNA,基因组末端含有一个6379 bp的序列相同但方向相反的反向重复序列(ITR)[26]。该病毒含有190个开放阅读框,其中四个位于ITR序列中[27](图1)。基因组的中心区域主要是编码重要的复制酶和病毒的结构蛋白的基因,这些基因具有高度的同源性,而编码毒力和宿主趋向性的基因大多位于基因组的两端,与天花病毒高度一致。目前,多种猴痘蛋白的结构和功能已被预测和分析,一些关于猴痘病毒变异基因的研究也已发表,但仍有部分基因的功能和表达情况有待进一步研究。
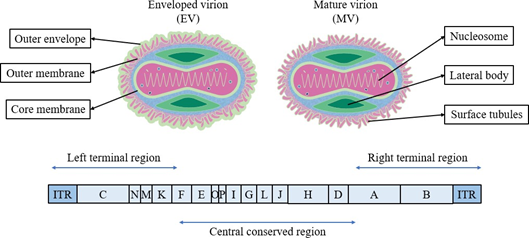
图1猴痘病毒的结构和基因组。该图的左上部分和右上部分分别显示了包膜病毒体(EVs)和成熟病毒体(MVs)的结构。EVs较MVs有一个额外的包膜。病毒膜表面由不规则形状的小管组成,内部由一个哑铃状的核和一对位于凹陷和外膜之间的侧体组成。图片的下半部分是猴痘病毒的基因组,数据来自ViralZone,SIB Swiss Institute of Bioinformatics。双链DNA长约197 kb,基因组末端包含一个末端反向重复序列(ITR)。中心区域主要是编码重要的复制酶和结构蛋白的基因,与天花病毒高度一致,具有高度同源性。
目前的疫情是由该病毒的西非分支引起的,其危险性一般低于中非分支,这两个分支的病毒基因组之间的遗传差异可能解释了病毒清除和致病机制的差异[28]。研究显示,2022年5月发现的猴痘疫情的相关病毒毒株是2018-2019年非洲地方性流行国家暴发的猴痘病毒的一个特征明确的演化支系,或代表了该病毒近期的演进变化[29]。当然,疾病严重程度的差异也可能受到传播途径、宿主易感性和感染病毒数量的影响,我们将在下文详细说明。
猴痘病毒在干燥条件下较稳定,在4℃或-70℃的环境中可以长时间保持活性,但不耐高温,56℃下20分钟就可被灭活。对乙醚有抵抗力,但容易被氯仿、甲醇、甲醛、乙醇、十二烷基乙酸钠和福尔马林等有机试剂灭活。
猴痘病毒可以在来源自猴子、兔子、牛、豚鼠、小鼠以及人类的细胞中生长,并产生独特的海绵状或斑块状的细胞病变效应。大多数感染猴痘病毒的细胞含有许多圆形或椭圆形的小型嗜酸细胞包含体。
传播机制及发病机制
猴痘是一种人畜共患病,人际传播不常见[30,31]。但近年来,该病的发病率逐年上升[22,30,32]。密切接触感染者的唾液、呼吸道分泌物、病变渗出物或结痂物质时,猴痘病毒可以通过破损的皮肤、眼睛、鼻子和口腔黏膜的创面进入人体。密切接触传播需要长时间的面对面接触,例如,在没有个人防护装备的情况下,2米半径内持续接触三个多小时[33,34]。猴痘病毒还会通过胎盘、产道由孕妇传播给胎儿,或在婴儿出生之后通过皮肤接触由受感染的亲代传播给子代[35]。被感染猴痘的动物咬伤或抓伤以及食用未正确烹煮的感染动物的肉也可能感染猴痘[36,37]。因此,应注意输入性动物的检疫和对患者旅行史的调查。近年来,性接触也被认为是一种潜在的人际传播途径,特别是男男性接触[38–40]。
病毒感染到皮疹发生之间,有一系列复杂的过程:病毒从黏膜或受损皮肤侵入人体,通过淋巴和血液在宿主体内传播,主要是通过受感染的白细胞传播[41]。然后,病毒在淋巴结部位复制繁殖,并通过血液循环到达皮肤上皮细胞和其他组织[42]。皮肤中的病毒会在几天内复制入侵上皮细胞导致真皮表面炎症,血管扩张、充血和炎症细胞浸润,随后导致皮疹、水疱等肉眼可见的病变[43](图2)。
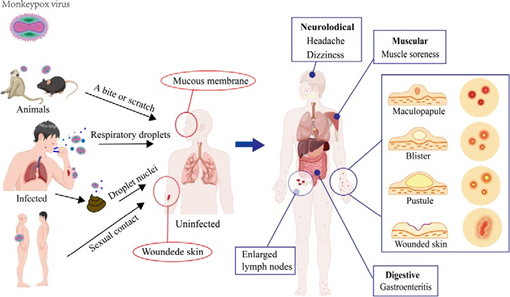
图2人猴痘的传播途径和临床症状。图的左边部分描述了猴痘病毒的传播途径。猴子、啮齿动物和感染猴痘病毒的患者等动物可能是感染源,传播方式包括动物叮咬、呼吸道飞沫、性接触以及接触受感染动物或患者的体液。右边部分描述了人类猴痘的临床症状。猴痘病毒感染后可影响身体多系统,主要特征为面部和四肢的皮疹。皮疹由丘疹变为水疱,再变为脓疱,10天后结痂,约3周后结痂消失。部分猴痘患者在皮疹期间会出现颈部、颌下、腋下或腹股沟的淋巴结肿大,该临床特征可用于区别猴痘和天花。该图是使用开放式在线科研绘图平台Figdraw绘制的。
感染期间猴痘病毒在细胞内复制繁殖,宿主免疫系统识别病毒或其表面表位,诱导机体产生先天性或获得性免疫反应。细胞表面模式识别受体(PRRs)识别病原相关分子模式(PAMP),启动先天免疫反应并激活炎症信号通路,引发局部炎症,促进促炎细胞因子(包括IL-6和TNF-α)、趋化因子(包括CXCL1和IL-8)和补体蛋白分泌[44,45]。细胞因子和趋化因子的分泌吸引更多的免疫细胞到达感染部位,进而引发皮疹和皮肤损伤等临床症状。
为对抗宿主免疫防御,猴痘病毒会发生一系列适应和调节,从而破坏或逃避由PRRs引发的宿主抗病毒反应。非洲猴痘抑制T细胞的激活,防止感染病毒细胞释放炎性细胞因子[46]。此外,中非猴痘毒株与西非毒株相比选择性下调宿主反应,特别是宿主细胞凋亡[47],并分泌免疫调节因子抑制补体酶,从而增强中非毒株的毒力[48]。循环抗体的出现与病毒消失和临床恢复密切相关。
临床表现
人猴痘病毒是一种人畜共患的正痘病毒,感染后临床表现与天花相似。猴痘的潜伏期为5-21天[49],感染者开始通常表现为发烧、头痛、疲劳、肌肉酸痛和淋巴结肿大等“流感样”症状[50,51],下颌下、颈部或腹股沟部位出现直径1-4厘米的淋巴结肿大、质地柔软、较固定(图2)。
患者通常在发烧、淋巴结肿大1-3天后出现皮疹,早期表现为斑疹和丘疹,随后迅速发展成疱疹,形成水疱和脓疱,并伴有局部淋巴结肿大,最后结痂,每个症状阶段可能持续1-2天[52-54]。猴痘皮损坚固、损害较深、边界清楚、中央有凹陷,皮损渗出物具有很强的传染性[55]。皮疹常开始于面部,后迅速扩散至四肢及其他部位,主要分布于面部、手掌和脚底,有时也会出现在生殖器、口腔、结膜和角膜上,情况严重时甚至遍布全身[42,56]。持续4周左右,皮疹消退脱屑[57]。
猴痘常常易被误诊为水痘和天花(刚果民主共和国多达50%的病例被误诊)[54]。人类猴痘与天花的主要区别是人类猴痘病毒会引起淋巴结肿大,常伴有发热;水痘带状疱疹病毒皮损通常外观较浅,边界不规则,可在身体任何部位同时出现多个阶段的皮疹,并在24小时内由斑疹迅速演变为结痂[58]。
对大多数人来说,猴痘是一种自限性疾病,感染后症状较轻,通常2-4周就能完全恢复。然而,症状的严重程度也与传播途径、病毒暴露程度和患者自身基础疾病密切相关。人类猴痘感染流行病学研究表明,儿童、孕妇和未接种天花疫苗人群感染后症状可能更严重,易出现继发性细菌感染、呼吸窘迫、肺炎、败血症、胃肠道感染、脑炎、角膜感染及视力丧失等并发症[19,52,59]。猴痘死亡率在普通人群中为0%-11%,在幼儿中更高。猴痘病毒暴发起源于西非分支,该分支的死亡率为3.6%,而中非进化分支的死亡率为10.6%[41]。
实验室检测是诊断和鉴定猴痘感染的重要组成部分。医疗专业人员采集确诊或疑似猴痘病例的相关临床标本(包括痘泡液、痘痂或病灶的拭子、咽拭子、全血、血清等标本),进一步开展相关病原学检测[50]。病毒分离和鉴定、电子显微镜和实时聚合酶链式反应是确诊猴痘感染的金标准检测方法,但需要具有高密封性设施实验室。采集皮疹、疱液、痂皮、口咽或鼻咽分泌物标本,感染Vero细胞后在病毒培养基中持续培养病毒,直至观察到完全CPE,以完成病毒分离和鉴定。电子显微镜下可观察到病毒胞浆呈圆形或椭圆形、中央有香肠状结构,大小约为200-400 nm。其他分子和抗原检测试验,如免疫组织化学和免疫荧光,可用于辅助临床诊断猴痘。血清学检测主要用于流行病学调查,需要在发病后5天内对急性和恢复期血清进行MPXV特异性IgM检测,或在8天后进行IgG检测[52]。值得注意的是,猴痘需要与天花、水痘、带状疱疹、单纯疱疹等其他疾病鉴别诊断。
治疗与疫苗
目前对于猴痘病毒感染尚无特效疗法,该病为一种自限性疾病,大多数患者无需特殊治疗。治疗方法主要为对症支持治疗,防治并发症,休息、补充水分和营养,加强护理,保持眼、鼻、口腔和皮肤清洁,可使用抗生素防止继发感染。特考韦瑞(Tecovirimat)、天花疫苗、西多福韦(Cidofovir)、布林西多福韦(Brincidofovir)和牛痘免疫球蛋白(VIG)等天花治疗药物在特定情况下可用于控制猴痘疫情暴发[60](表1)。然而,目前还没有关于Cidofovir、Brincidofovir和VIG治疗人类猴痘病例有效性的数据,尚不清楚猴痘严重感染者能否从中受益,但紧急情况下可以考虑使用。
表1 猴痘预防与治疗
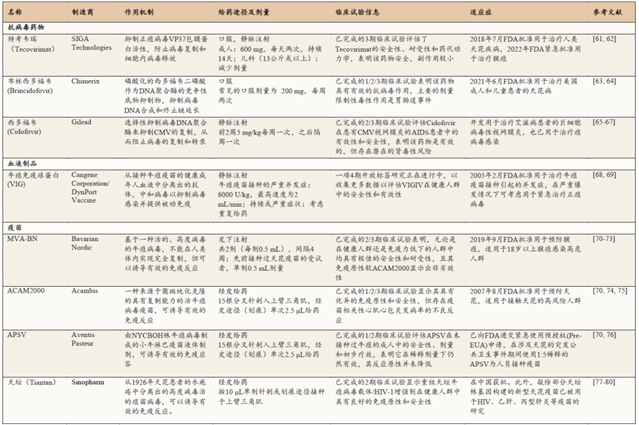
2022年1月,用于治疗天花的抗病毒药物Tecovirimat(TPOXX)被美国食品药品监督管理局(FDA)批准用于治疗猴痘。Tecovirimat靶向抑制高度保守的正痘病毒VP37蛋白的活性,阻断正痘病毒VP37蛋白与细胞Rab9 GTP酶和TIP47的相互作用,从而防止输出感染性包膜病毒粒,从而抑制病毒的细胞间传播和远程传播[81]。多项关于抗病毒药物Tecovirimat在动物模型中的治疗效果研究表明,Tecovirimat能有效治疗正痘病毒引起的疾病,且疾病临床体征和症状与安慰剂组相比明显改善[82-84]。此外,人体临床试验表明,Tecovirimat药物安全性及耐受性良好、副作用较小[85,86]。然而,目前尚无有关Tecovirimat治疗人类猴痘病例有效性的数据。
由于猴痘病毒与天花病毒密切相关,因此接种天花疫苗对包括猴痘在内的其他正痘病毒感染具有交叉免疫作用。研究表明,天花疫苗对猴痘病毒有效性高达85%。然而自1980年全球消除天花后[6],全球各国陆续停止了天花疫苗的接种,以致世界各地40岁(或50岁)以下的人群不再受益于之前天花疫苗接种计划所提供的保护,对猴痘无免疫力。即使是曾经接种过天花疫苗的人群,由于时间过久,免疫力下降,对猴痘病毒的保护能力也有限。
改良安卡拉痘苗病毒(MVA)是一种高度减毒的痘苗病毒,不能在哺乳动物细胞中完全复制。非复制型天花疫苗MVA-BN(也称为Imvamune、Imvanex或Jynneos),于2019年被FDA批准用于预防猴痘。目前,它主要用于要进行有暴露风险工作和暴露人群的接种,一般人群并不推荐接种。MVA-BN对猴痘的有效性已通过多项临床免疫原性研究和动物疗效研究验证[87–89]。MVA-BN在免疫原性方面与FDA批准的另一复制型天花疫苗ACAM2000相比,显示出非劣效性[90,91]。但传统的复制型天花疫苗在普通人群中存在严重的安全性问题,而MVA-BN的安全性已在多项临床试验得到充分证明,MVA-BN具有良好的安全性、耐受性和免疫原性。在健康试验人群和免疫功能低下人群中均没有出现重大的安全性问题,特别是心脏安全性问题[72,92]。且在接种过牛痘的人群中,MVA-BN能够快速增强由先前接种传统天花疫苗所诱导的长期B细胞记忆反应[93]。此外,中国自主研发生产的天坛天花疫苗和美国安万特巴斯德天花疫苗(APSV)等具有预防猴痘潜力的天花疫苗或能作为后备资源紧急用于猴痘防治。
未来应对措施
如今,猴痘病毒已经大量扩散影响到非洲以外的多个地区。本次暴发的猴痘疫情很不寻常,短时间内在非流行区出现这么多不明感染源的猴痘确诊病例,让人无法不感到担忧。此次不寻常的猴痘暴发有许多可能的原因,包括天花疫苗接种人群比例下降,国际旅行越来越频繁,以及猴痘病毒对人类宿主的适应性变异[23,29,94]。然而,凭借人类多年来对抗传染病的经验,我们不需要恐慌。
从本质上讲,人畜共患疾病就是感染性疾病。因此,控制传染源、切断传播途径、保护脆弱和易感人群等预防和控制感染性疾病的原则同样适用于猴痘等人畜共患疾病。
为防止漏诊和误诊,临床医生,特别是皮肤科医生和流行病学专家,应将猴痘感染作为水疱疹的临床综合征进行鉴别诊断,并应联系疾病预防控制或相关机构进行测序鉴定[40]。对猴痘阳性或疑似的患者和动物应及时隔离,并启动反向和正向接触追踪。
还应严格限制野生动物的进口,特别是任何非洲啮齿动物。前往流行国家的居民和旅行者应避免接触可能携带猴痘病毒的患病动物(啮齿动物、有袋动物、灵长类动物),并应避免食用或处理野生动物。旅行期间或从流行区返回后的任何疾病都应向卫生专业人员报告。照顾疑似或确诊猴痘患者的卫生工作者和其他护理人员应采取标准的控制预防措施,防止接触和飞沫传播感染。从疑似猴痘患者或疑似感染猴痘病毒的动物身上采集的样本,应由经过培训的人员在有适当设备的实验室中安全处理。
应始终强调保持良好的卫生习惯。其他预防措施包括在进食前、如厕后以及与疑似受感染的人或动物接触后涂抹肥皂水或酒精消毒剂,以保持手部卫生。在人群密集的地方也应戴上医用口罩。
自20世纪80年代全球宣布消灭天花以来,世界各地的人群不再受益于以前的天花疫苗接种计划所提供的保护,因此,在那之后出生的人口普遍缺乏相应的免疫力,属于易感人群。此外,即使那些已经接种过牛痘疫苗的人也有风险,因为抗体免疫力会随着时间的推移而大大降低。如果有疫苗,在进行风险效益评估后,应考虑为高风险的密切接触者接种疫苗。
我们不应该放松警惕,相反,我们应该加强对猴痘病毒的预防意识,科学家应该加强对病毒本身的研究,充分了解病毒,探索这种异常暴发的原因。此外,我们应该开发更好、更准确的诊断试剂,及时发现输入性病例。同时,应该开始储备强效疫苗和抗病毒药物,避免在病例出现时处于被动局面。
几千年来,人类社会的发展始终与不同传染病的出现、流行和控制交织在一起。只有不断深入了解传染病的流行规律,才能尽最大努力让人类远离传染病,守护人类的健康和尊严。
参考文献(点击下方蓝色英文标题,可下载全文及参考文献)
原文信息
标题
Unusual global outbreak of monkeypox: what should we do?
作者
Miaojin Zhu, Jia Ji, Danrong Shi, Xiangyun Lu, Baohong Wang, Nanping Wu, Jie Wu, Hangping Yao, Lanjuan Li
机构
1. State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, National Clinical Research Center for Infectious Diseases, Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases, The First Affiliated Hospital, School of Medicine, Zhejiang University, Hangzhou 310003, China
2. Jinan Microecological Biomedicine Shandong Laboratory, Jinan 250117, China
Corresponding AuthorsLanjuan Li,Hangping Yao, and Jie Wu
Cite this article
Miaojin Zhu, Jia Ji, Danrong Shi, Xiangyun Lu, Baohong Wang, Nanping Wu, Jie Wu, Hangping Yao, Lanjuan Li. Unusual global outbreak of monkeypox: what should we do?. Front. Med., 2022. Just Accepted Version available at
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-022-0952-z
点击上方蓝色链接, 可下载全文,了解更多内容。 感谢作者对Frontiers of Medicine的信任和支持。
《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、 、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中13种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。