|
|
| 尹玉新课题组发现单链DNA结合蛋白RPA1蛋白全新的生理功能 |
|
非酒精性脂肪性肝病(NAFLD)是最常见的慢性肝脏疾病之一,以过量脂质在肝细胞内蓄积为主要病理特征。NAFLD病理生理机制仍未完全阐明,临床上仍缺乏有效的治疗手段。因此,深入研究NAFLD的发病机制成为肝脏领域和代谢领域的研究热点。
2022年7月12日,北京大学基础医学院尹玉新团队在Cell Reports杂志上在线发表了题为“RPA1 Controls Chromatin Architecture and Maintains Lipid Metabolic Homeostasis”的研究论文。该论文通过构建小鼠模型,应用pull-down、RNA-seq、ATAC-seq以及Cut&tag等多组学手段发现了单链DNA结合蛋白RPA1在脂肪肝发生发展中起着重要作用。
尹玉新课题组于2015年首次建立了Rpa1敲除小鼠模型(Cell Res. 2015.),观察显示杂合丢失Rpa1的小鼠(Rpa1+/-)更易诱发结直肠癌。该论文进一步发现Rpa1+/-小鼠对脂肪肝更易感,在年龄增长或者高脂饮食(high fat diet)的诱导下会出现脂肪肝表型。为了深入研究RPA1在脂肪肝发生发展中的作用,课题组新构建了肝脏组织特异性Rpa1(Liver-Rpa1-KO) 敲除的小鼠模型,发现Liver-Rpa1-KO小鼠在四周年龄患脂肪肝并逐渐进展为肝癌,在56周年龄的时候66.7% Liver-Rpa1-KO小鼠进展为肝癌。通过Pull-down,RNA-seq,ATAC-seq,Cut&tag等多组学手段,以及Seahorse等实验,发现了RPA1可以通过与转录因子HNF4A,染色质重塑因子FACT复合体等相互作用,调控脂代谢相关基因染色质可及性,从而调控脂代谢相关基因的转录。敲除Rpa1导致肝脏染色质处于更加致密的状态,抑制脂代谢相关基因的转录,导致肝细胞脂肪酸β-氧化速率的降低,脂肪的积累,小鼠脂肪肝的发生。另外,通过组织芯片免疫组化染色发现RPA1蛋白在临床脂肪肝病人肝脏样本中表达水平降低,说明了RPA1在临床脂肪肝发生中起着重要作用。
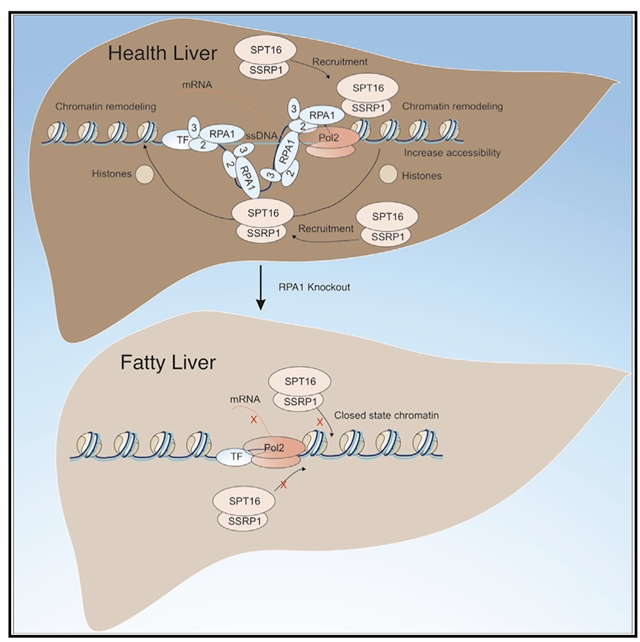
综上所述,该研究证实了RPA1可以通过调控染色质构象调控基因转录,发现了RPA1蛋白在非酒精性脂肪性肝病中的重要作用,从表观遗传的角度进一步揭示了非酒精性脂肪性肝病的发病机制,为相关疾病预防以及创新药物研发提供了新的思路。
北京大学医学部博士后尹奇,基础医学院李扬博士为该文章的共同第一作者,北京大学系统生物医学研究所尹玉新教授为通讯作者。该工作得到了北京大学基础医学院郭丽梅副教授的大力支持。该研究得到国家重点研发计划、国家自然科学基金重点项目、国家自然科学基金青年项目,北大-清华 联合中心项目的支持。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.celrep.2022.111071