近日,北京大学未来技术学院分子医学研究所研员陈雷课题组发现了钠漏通道NALCN-FAM155A-UNC79-UNC80复合物的冷冻电镜结构及UNC79-UNC80调节NALCN-FAM155A的机制。这一研究于5月12日发表在《自然-通讯》上。
神经细胞的静息膜电位(Resting Membrane Potential, RMP)影响着神经细胞的可兴奋性,对于维持神经细胞正常的生理功能至关重要。钠漏通道NALCN(Sodium Leak Channel, Nonselective)介导了神经细胞的钠漏电流,能使静息膜电位更加去极化,从而提高神经细胞的可兴奋性。
NALCN在哺乳动物中高度保守,与电压门控钙离子通道(CaV)和电压门控钠离子通道(NaV)同源性较高。且参与了诸多与神经系统相关的重要的生物学过程,包括呼吸节律的调节、痛觉感知、生物钟的调节和快速动眼睡眠等。
“在人群中,NALCN的单点突变会引起多种严重的神经发育遗传疾病,包括精神运动发育迟缓和具有特征面相的小儿肌张力低下症及四肢和面部先天性挛缩、肌张力低下和发育迟缓症等。尽管NALCN通道有着如此重要的功能,但其工作机制仍不清楚。”陈雷告诉《中国科学报》。
在2020年,陈雷研究组曾解析NALCN-FAM155A亚复合体的高分辨率结构,阐明了NALCN的钠离子选择性、胞外钙离子阻塞和电压调节特性的结构基础,发现了在NALCN通道中独有的位于II-III linker上的CIH螺旋可以结合在其胞内结构域上。但是UNC79和UNC80的结构以及它们是如何激活NALCN的并不清楚。
先前的研究表明,UNC79和UNC80容易与NALCN-FAM155A亚复合体发生解离。在本项研究中,作者们在NALCN的C末端融合了GFP,UNC80的N末端融合了与GFP高亲和力结合的纳米抗体以稳定UNC79/80与NALCN间的相互作用。
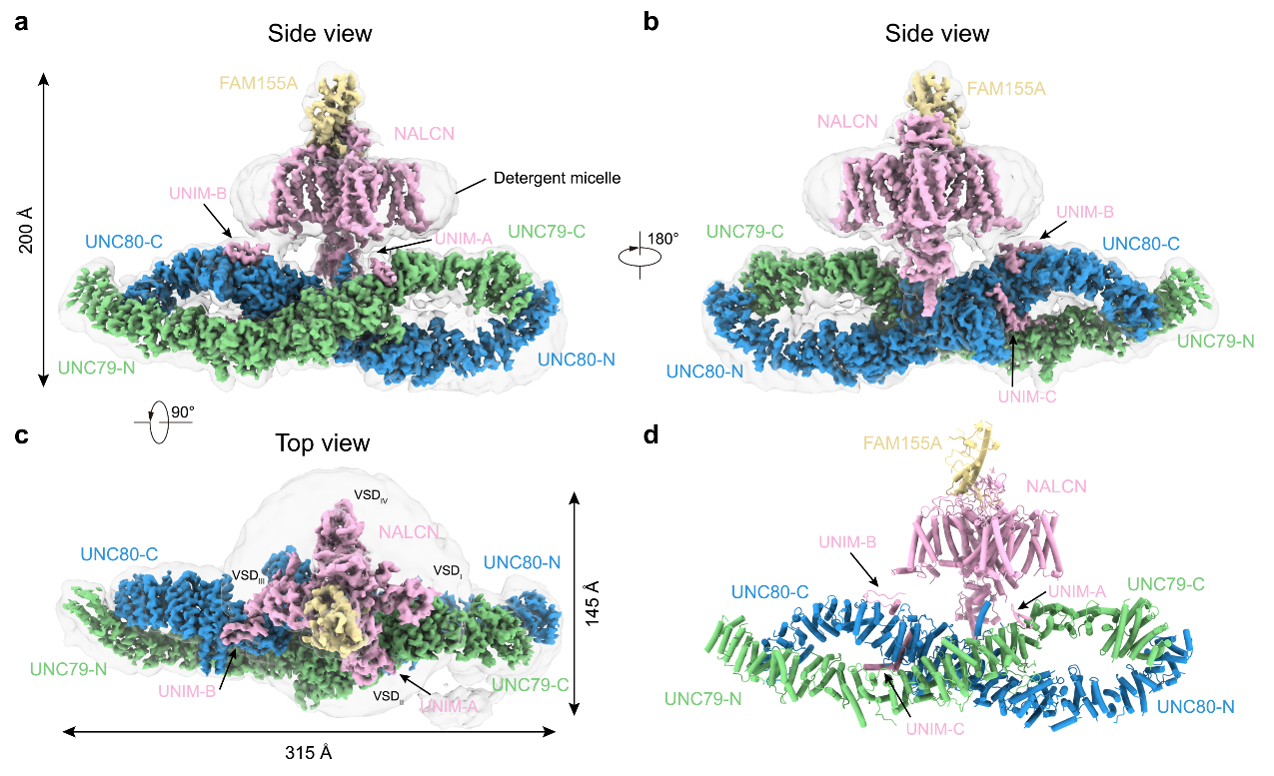
经过同源蛋白筛选等步骤,研究人员确定以大鼠NALCN和小鼠FAM155A, UNC79和UNC80亚基组成的复合体为研究对象,并在克服了样品制备、数据处理等困难后,通过单颗粒冷冻电镜技术获得了整体分辨率为3.2埃的四元复合物的电子密度,并搭建了原子模型。
结构显示,UNC79和UNC80均由富含螺旋的结构组成,这些螺旋进一步的组装成HEAT重复或ARM重复等超螺旋结构。UNC79的N端与UNC80的C端、UNC79与UNC80的中间铰链区以及UNC79的C端与UNC80的N端均存在着紧密的相互作用,形成钳子状的复合体,整体形状类似于无穷号“∞”。
NALCN-FAM155A-UNC79-UNC80复合体的结构 (采访对象供图,下同)
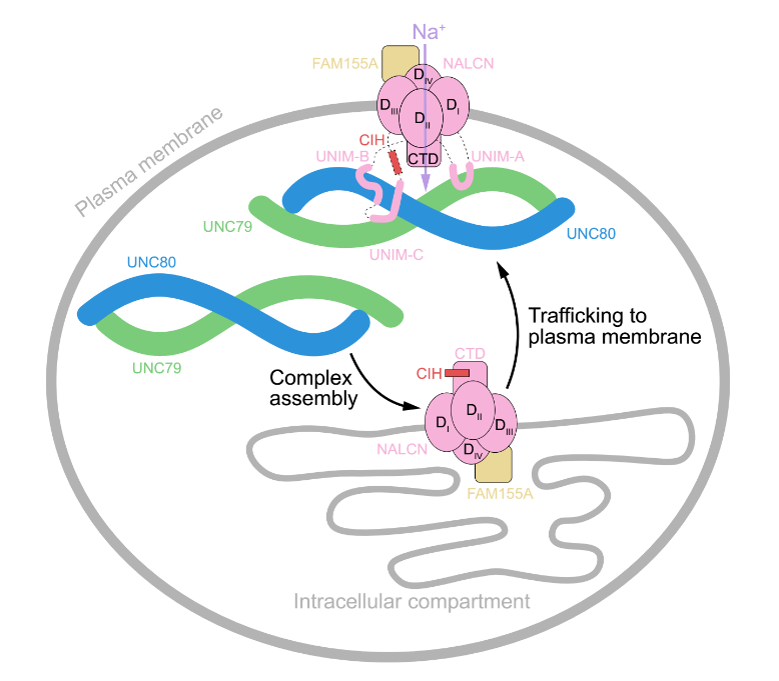
进一步的研究发现,NALCN主要通过胞内loop区与UNC79-UNC80发生相互作用的:NALCN胞质侧的I-II linker中的一段β-发卡结构(UNIM-A)与UNC79发生相互作用,II-III linker中的一段loop-螺旋结构(UNIM-B)以及一段L型螺旋结构(UNIM-C)与UNC80发生相互作用(图1)。作者们将NALCN与UNC79/80发生相互作用的基序命名为UNC Interacting Motif (UNIM)。
UNC79-UNC80激活NALCN的机制的示意图
陈雷介绍,该项研究还发现,UNC79, UNC80和FAM155A三个附属亚基对于NALCN能够正确的转运到细胞膜上是必不可少的。“这有可能是因为这些互作使UNC79/80遮挡了NALCN胞质侧loop上的内质网滞留信号,从而促进NALCN上膜。另外,这些互作也释放了CIH对NALCN的自抑制,使其激活。这为深入理解NALCN复合体的工作机制奠定了基础。”他说。(来源:中国科学报 刘如楠 )
相关论文信息:https://doi.org/10.1038/s41467-022-30403-7
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。