|
|
| Cancers:“分子癌症生物学” 专题——关注分子癌症生物学前沿研究 | MDPI Cancers |
|
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650055533&idx=1&sn=
499f049d5e727f9e158a5f461b00bf21&chksm=f1d919a9c6ae90bff7e88bdfd1079aad918
ca7efe0a848f69656e812fb7ec0406556e8010a5a&token=1792528896&lang=zh_CN#rd
期刊链接:
https://www.mdpi.com/journal/cancers
Molecular Cancer Biology (分子癌症生物学) 专题是Cancers期刊15个专题之一,由Prof. Dr. Donat Kögel担任主编,并联合300位全球知名学者组成编委会。截止2022年1月,该专题共开设了92个特刊。
专题主编介绍

Donat Kögel 教授
德国法兰克福大学
神经科学中心实验神经外科主任、德国转化癌症研究联盟 (DKTK) 成员。研究领域包括内在和获得性治疗抗性、细胞凋亡、自噬、肿瘤细胞迁移和侵袭的机制等。发表了多篇优秀科研论文,被引用超过5000次。
专题简介
在生理条件下控制细胞和组织稳态、生长和发育的复杂生物过程失调是肿瘤发生、肿瘤进展和癌症治疗抵抗的关键驱动因素。更好地了解癌症生物学这三个关键方面有助于学者了解新靶点和开发治疗等破坏性疾病的新治疗方法。Cancers期刊的专题“分子癌症生物学”涵盖癌症的发展、进展和治疗相关的分子和细胞生物学的所有方面。主题包括但不限于:
1. 肿瘤发生和癌症进展;
2. 癌症免疫学;
3. 药物发现和靶向治疗;
4. 肿瘤侵袭和转移;
5. 癌症干细胞生物学;
6. 基因组不稳定性;
7. DNA损伤和修复;
8. 细胞周期调节;
9. 缺氧;
10. 癌细胞代谢;
11. 治疗抵抗的机制;
12. 自噬;
13. 细胞凋亡;
14. 坏死;
15. 衰老;
16. 血管生成;
17. 炎症和癌症。
专题精彩综述文章推荐
1 FGF/FGFR-Dependent Molecular Mechanisms Underlying Anti-Cancer Drug Resistance
抗癌药物耐药性的FGF/FGFR依赖分子机制
Jakub Szymczyk et al.
DOI:10.3390/cancers13225796
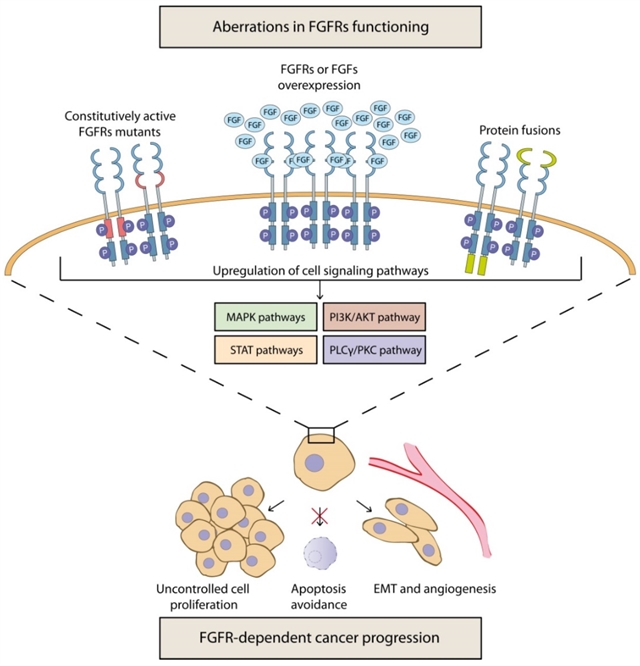
图1.FGFRs介导的癌症发展和进展机制。
有研究发现,许多癌症中的FGF蛋白及其受体的表达增加通常与化学抗性的发展有关,并且其限制了现行抗癌疗法的有效性。癌细胞中FGF/FGFR轴的功能失调产生了许多可能影响肿瘤对所用药物敏感性的分子机制。最重要的是细胞信号传导的失调可能导致细胞增殖、存活和运动性增加,并最终导致恶性肿瘤。FGFRs激活的信号通路抑制细胞凋亡,也能降低一些抗癌药物的细胞毒作用。作者认为基于FGF/FGFR抑制 (使用受体抑制剂、配体陷阱、单克隆抗体或microRNA) 的治疗策略似乎非常有希望。但是,这种方法可能会通过获得特定突变、代谢转换和分子串扰而导致耐药性的进一步发展。本文综述了有关FGF/FGFR轴参与癌症耐药性产生机制的最新研究,作者强调需要进一步研究,通过新的治疗策略克服这一严重问题。
2 Crosstalk between KRAS, SRC and YAP Signaling in Pancreatic Cancer: Interactions Leading to Aggressive Disease and Drug Resistance
胰腺癌中KRAS、SRC和YAP信号之间的串扰:导致侵袭性疾病和耐药性的相互作用
Enrique Rozengurt and Guido Eibl
DOI:10.3390/cancers13205126
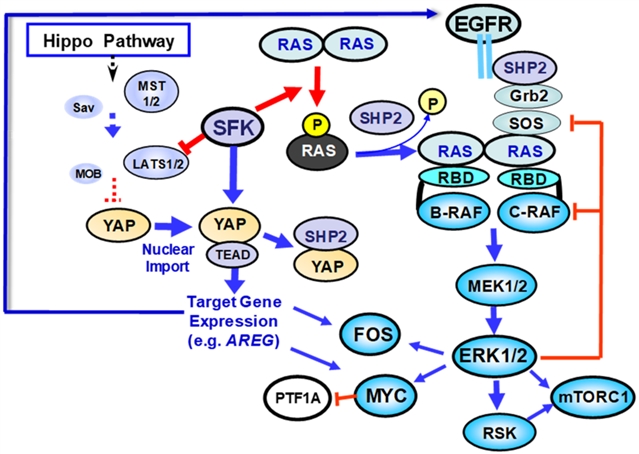
图2.SFK介导的磷酸化对KRAS和YAP功能的相反影响。
胰腺导管腺癌这种毁灭性疾病 (PDAC) 是胰腺癌中最主要的。这本文综述了关于机械和转化发展的最新文献,其加深了作者对PDAC开发和维护中KRAS、YAP和Src酪氨酸激酶家族 (SFK) 之间复杂串扰情况的理解。作者讨论了近期研究中RAS二聚化在信号转导中的重要性及新发现后表明SFK的强效促癌成员磷酸化并抑制RAS功能。作者认为这些发现意味着RAS可能在维持某些PDAC亚型中起关键作用。目前有研究表明,基底样PDAC亚型的存活很少依赖于RAS,有部分依赖于YAP/TAZ的活性。根据目前的研究证据,作者提出SFK可以推动PDAC细胞进入高转移状态、上皮间质转化 (EMT) 和减少对KRAS信号传导的依赖,这是PDAC侵袭性基底样/鳞状亚型的显著特征。作者发现设计针对这些新型串扰机制并克服耐药性的药物组合时,PDAC治疗策略应考虑酪氨酸磷酸化对KRAS和SFK/YAP的相反影响。
专题特刊推荐
1 Signalling Pathways of Cancer Stem Cells
Edited by Moorthy P. Ponnusamy
Submission Deadline:1 June 2022
https://www.mdpi.com/journal/cancers/special_
issues/signalling_pathways_cancer_stem_cells
2 Notch Signaling Pathway in Cancers
Edited by Stephanie Roessler
Submission Deadline:15 September 2022
https://www.mdpi.com/journal/cancers/special_
issues/Notch_Signaling_Pathway
3 Involvement of RNA Polymerases I and III in Cancer Progression
Edited by Robert J. White
Submission Deadline:31 October 2022
https://www.mdpi.com/journal/cancers/special_issues/RNAIAIII
4 Cancer Cell Metabolism, Glycolysis, Lactate Production and Transport and Potential Therapeutic Options for Inhibitors
Edited by Christopher J. Rivard
Submission Deadline:1 November 2022
https://www.mdpi.com/journal/cancers/special_
issues/Cancer_Cell_Metabolism_Glycolysis
5 MAPK/Akt Signaling Pathways: Function, Regulation, Signaling, and Implications for Cancer Treatment
Edited by Erika Peverelli
Submission Deadline:15 November 2022
https://www.mdpi.com/journal/cancers/special_issues/MAPKAktSP
Cancers期刊介绍
主编:Samuel C. Mok, The University of Texas MD Anderson Cancer Center, USA
期刊主题涵盖癌症治疗和免疫疗法、癌症生物标志物、流行病学和预防、肿瘤微环境、癌症病因和筛查、诊断和护理、癌症分子生物学等肿瘤学领域的各个方面。目前,期刊已被SCIE、Scopus等重要数据库收录。
2020 Impact Factor:6.639
2020 CiteScore:4.4
Time to First Decision:18 Days
Time to Publication:36 Days


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。