|
|
|
|
|
来自解脂耶氏酵母的一种兼职蛋白:N-乙酰氨基葡萄糖激酶 | MDPI IJMS |
|
|
论文标题:The N-Acetylglucosamine Kinase from Yarrowia lipolytica Is a Moonlighting Protein
期刊:International Journal of Molecular Sciences
作者:Carmen-Lisset Flores, Joaquín Ariño and Carlos Gancedo
发表时间:3 December 2021
DOI:10.3390/ijms222313109
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650056240&idx=4&sn=f96
ec7bb36a4895c02a5a3c3e2775fa6&chksm=f1d91cf4c6ae95e2352b75ecabaabc10b024290
633792f1afaaf1ff6cf8f9ec04ae18c99759a&token=1792528896&lang=zh_CN#rd
期刊链接:
https://www.mdpi.com/journal/ijms
摘要
在微生物利用N-乙酰氨基葡萄糖激酶 (N-Acetylglucosamine Kinase) 降解氨基糖N-乙酰葡糖胺 (NAGA) 的相关研究中,研究人员发现该蛋白在解脂耶氏酵母 (Yarrowia lipolytica) 细胞内同时具备代谢激酶和调控蛋白活性的特点,参与了NAGA分解代谢途径基因的表达。本文通过测定酵母细胞生长活力,逐步明确了该蛋白在解脂耶氏酵母细胞中的兼职蛋白活性。
引言
NAGA是多种生物多糖的单体组成部分,在自然界中有许多微生物能够将NAGA同化为碳源和氮源[1]。然而在1500多种酵母菌中,只有少数能在NAGA作为碳源的环境中生长[2],如解脂耶氏酵母,与模型酵母酿酒酵母不同,YlNAG5基因调控的NAGA激酶对氨基糖的磷酸化过程[3]、脱乙酰步骤和脱氨基异构化、生成的6-磷酸果糖进入糖酵解途径都具有重要作用 (如图1)。值得注意的是,编码这些调控通路的基因 (NAG基因) 是由培养基中的NAGA存在与否来决定的,上述这些调控基因在细胞暴露于葡萄糖环境中时的表达含量很低,然而当NAGA作为碳源时,这些NAG基因的表达含量呈20-40倍的上调[3]。如果缺失YlNAG5这一编码NAGA激酶的基因,则会消除这种基因调控作用,并使这些基因的表达不再受控于NAGA [3]。
对上述现象可以做出下述两种假说:(1) Nag5可能是一种具有两种功能的兼职蛋白,同时担当代谢激酶和调控蛋白的功能;(2) 突变体中NAG基因的转录失调是由来自细胞从别的途径转化生成的NAGA。因此研究者们为了区分这两种可能性,设计了如下研究过程:
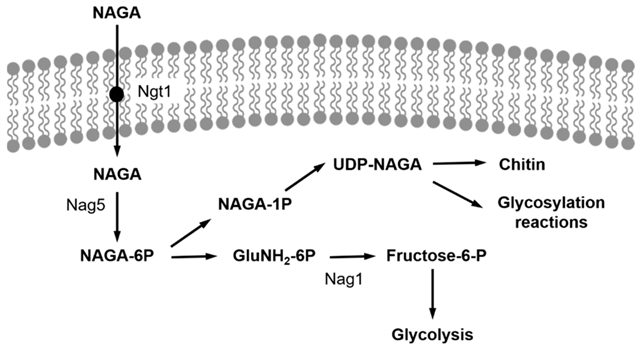
图1. 解脂耶氏酵母中NAGA的利用途径。
1. 建立反映NAG基因表达活性的指标
NAG基因表达能力强弱与葡糖胺-6-磷酸脱氨酶 (由基因YlNAG1 (YALI0C01419g) 编码) 的活性之间的联系需要以下两个条件成立:
(1) YlNAG1 mRNA的水平应与途径中其他基因的mRNA水平呈现平行变化;
(2) 在不同培养条件下,YlNag1需遵循与其编码mRNA相同的调控模式。
本文证明了上述两个条件的成立,并证实了YlNAG1作为报告基因对NAGA分解代谢途径基因去阻遏的作用。
2. 研究NAGA转运蛋白对Ylnag5突变体中NAG基因的失调表达的影响
如图1中NAGA的摄取需要转运蛋白Ngt1,它可以在Ylnag5突变体中积累。野生型菌株中YlNGT1基因的缺失阻碍了其在NAGA中的生长 (图2),从而证实了解脂耶氏酵母中没有其他相关的氨基糖转运蛋白。在解脂耶氏酵母细胞中,Ylgt1 nag5双突变体也被成功构建,并在其中检测出Nag1的活性。如图3所示,该双突变体中的Nag1活性与在葡糖生长的Ylnag5单突变体相近,说明在葡糖生长的Ylnag5突变体中NAG基因改变不是由胞内NAGA积累造成的。
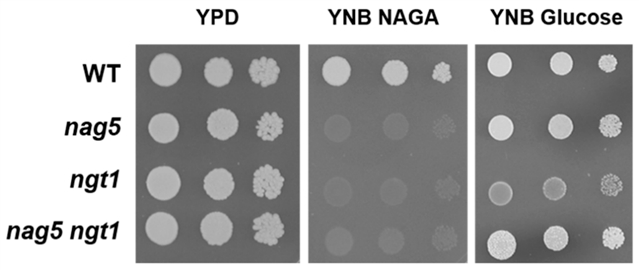
图2. 解脂耶氏酵母在YlNAG5和YlNGT1基因被破坏后的生长行为。
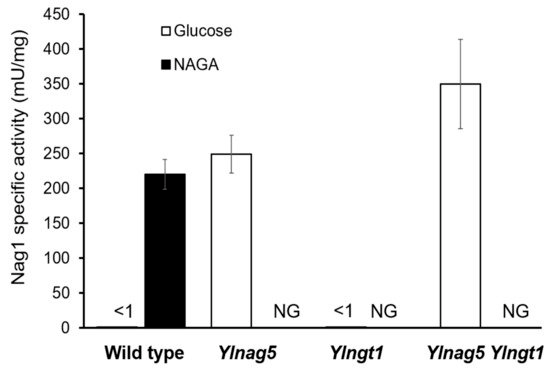
图3. Nag1在不同突变株与不同生长底物中的比活性。
3. 评估YlNag5的酶促和调节活性
为了确定NAGA激酶的代谢活性是否和NAG基因表达调控相互独立,研究人员在Ylnag5突变体中插入来自拟南芥、人类和稻瘟病菌的异源NAGA激酶[6,7],并研究了YlNAG5随机突变体的表达情况。稻瘟病菌 (Magnaporthe oryzae) 蛋白质G4NB55被预测为NAGA激酶[3]。如图4,用阴性对照质粒转化的菌株保持了在原始突变菌株中观察到的特征:无激酶活性和Nag1活性;拟南芥来源的蛋白质呈现在WB条带中 (AnNAGAK),转化菌株则没有显示出相应条带,但被转化了拟南芥重组蛋白的菌株的Nag1活性比阴性对照降低了约4倍,证实激酶活性及其对NAG基因表达的影响是相互独立的。除此之外,G4NB55也被发现允许该突变株在NAGA中生长并完全抑制NAG基因在葡萄糖培养基中的表达。上述结果证明,稻瘟病菌G4NB55也是一种NAGA激酶。
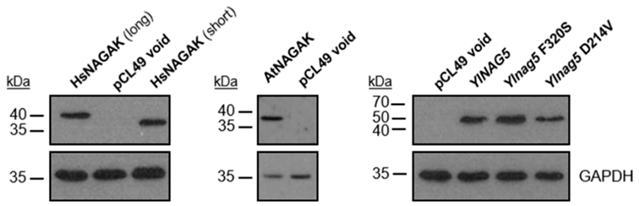
图4. 异源NAGA激酶表达和解脂耶氏酵母NAGA激酶突变形式的免疫印迹分析。
随后,研究人员通过蓝白版筛选实验确认Nag5酶活性与其调节能力没有相关性。研究人员发现其可在NAGA中生长,并在葡萄糖中呈蓝色的转化体中发生了基因突变。对这些突变位点的研究表明,Ylnag5突变体表现出降低的激酶活性 (如图5B)。然而,Nag1的活性在所有这些菌株中都相似。
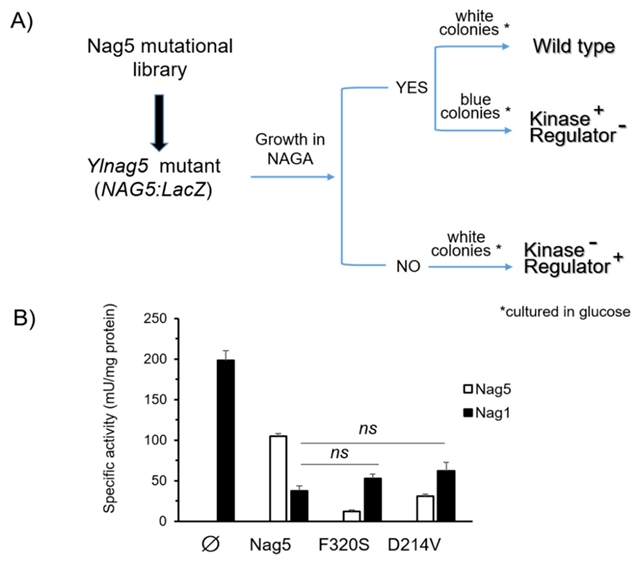
图5. (A) 不同YlNag5突变体的分离过程;(B) 在葡糖生长菌株的Nag5和Nag1活性。
4. Ylnag5突变引起的转录变化及基因富集分析
RNA-seq分析了Ylnag5突变体与野生型在葡萄糖中生长的基因表达差异,发现YlNAG5突变导致的影响十分有限。此外,基因富集发现两个表达含量显著增加的基因:YALI0F04466g和YALIF04169g。
综合以上研究结果,兼职蛋白质的概念[4,5]拓宽了人们对这些分子功能的看法,表明许多具有代谢功能的蛋白质参与了与代谢无关的过程[8,9]。YlNag5的行为表明它在抑制NAGA利用途径的酶的合成方面发挥了作用。而解脂耶氏酵母的NAGA激酶可能就属于这一类。
参考文献
1. Álvarez-Añorve, L.I.; Calcagno, M.L.; Plumbridge, J. Why does Escherichia coli grow more slowly on glucosamine than on N-acetylglucosamine? Effects of enzyme levels and allosteric activation of GlcN6P deaminase (NagB) on growth rates. J. Bacteriol.2005, 187, 2974–2982.
2. Kurtzman, C.P.; Fell, J.W.; Boekhout, T. The Yeasts: A Taxonomic Study, 5th ed.; Elsevier: Amsterdam, The Netherlands, 2011.
3. Flores, C.L.; Gancedo, C. The gene YALI0E20207g from Yarrowia lipolytica encodes an N-acetylglucosamine kinase implicated in the regulated expression of the genes from the N-acetylglucosamine assimilatory pathway. PLoS ONE2015, 10, e0122135.
4. Jeffery, C.J. Moonlighting proteins. Trends Biochem. 1999, 24, 8–11.
5. Jeffery, C.J. Why study moonlighting proteins? Front. Genet. 2015, 6, 211.
6. Furo, K.; Nozaki, M.; Murashige, H.; Sato, Y. Identification of an N-acetylglucosamine kinase essential for UDP-N-acetylglucosamine salvage synthesis in Arabidopsis. FEBS Lett. 2015, 589, 3258–3262.
7. Hinderlich, S.; Berger, M.; Schwarzkopf, M.; Effertz, K.; Reutter, W. Molecular cloning and characterization of murine and human N-acetylglucosamine kinase. Eur. J. Biochem.2000, 267, 3301–3308.
8. Gancedo, C.; Flores, C.L. Moonlighting proteins in yeasts. Microbiol. Mol. Biol. Rev. 2008, 72, 197–210.
9. Gancedo, C.; Flores, C.-L.; Gancedo, J.M. The Expanding Landscape of Moonlighting Proteins in Yeasts. Microbiol. Mol. Biol. Rev.2016, 80, 765–777.
原文出自IJMS期刊
Flores, C.-L.; Ariño, J.; Gancedo, C. The N-Acetylglucosamine Kinase from Yarrowia lipolytica Is a Moonlighting Protein. Int. J. Mol. Sci. 2021, 22, 13109.
IJMS 期刊简介
主编:Maurizio Battino, Università Politecnica delle Marche, Italy
期刊发表生物化学与分子生物学、生物材料、生物物理、生物医学和化学等分子相关领域研究,已被Scopus、SCIE (Web of Science)、PubMed等数据库收录。
2020 Impact Factor: 5.924
2020 CiteScore: 6.0
Time to First Decision: 16 Days
Time to Publication: 34 Days


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。