|
|
| 罗凌飞组发现重度脑梗后保命的应急新生血管是淋巴管转变而来 |
|
西南大学罗凌飞研究组发现,脑梗发生后,部分内生脑膜淋巴管迅速转分化形成受损脑区最早的新生血管并恢复应急血供,这种转分化对于重度脑梗后维持个体生命非常重要。
2021年9月24日,国际权威学术期刊Developmental Cell(《发育细胞》)在线发表了这一研究成果。
急性脑梗发生后,促进缺血半影区乃至梗死区迅速产生应急血供对于减轻急性症状、降低损伤和致死率并改善预后至关重要,也是随后损伤脑区实现再血管化的基础。罗凌飞组2019年在《发育细胞》上报道了脑梗和脑血管网损伤的斑马鱼模型,发现脑梗后脑膜淋巴管能够快速响应损伤进入受损脑区形成内生淋巴管,这一现象后来在哺乳动物脑梗模型中也被证实。内生淋巴管发挥排除脑水肿并作为生长轨道引导新生脑血管生长的重要功能。然而,新生血管通过淋巴管引导的方式完成再生是一个耗时较长的过程,无法满足受损脑区急需基本血供的要求。应急新生血管在受损脑区中如何快速形成尚未得到回答。
在罗凌飞教授的指导下,陈静影博士和博士研究生李秀华等首先利用Cre/loxP介导的谱系示踪系统发现部分内生脑膜淋巴管会转分化形成血管;随后,利用高分辨率活体实时成像等技术清晰地展示了内生淋巴管快速转分化转变为最早的功能血管,并与受损脑区残留脑血管连接融合恢复应急血流。机制研究显示Notch信号在内生淋巴管中的激活是转分化发生所必需的,抑制Notch信号使得内生淋巴管无法转分化为应急新生血管,从而无法恢复应急血供而导致重度脑梗后的个体致死。单次跨膜受体EphB4a被配体EphrinB2a激活后可抑制Notch信号,从而使得部分内生淋巴管维持淋巴管状态,继续发挥排除脑水肿功能并引导晚期新生血管生长。淋巴管转分化与未转分化的平衡完美体现了内生脑膜淋巴管在重度脑梗后,同时保障排除脑水肿和应急血管快速新生两项重要功能间的平衡。
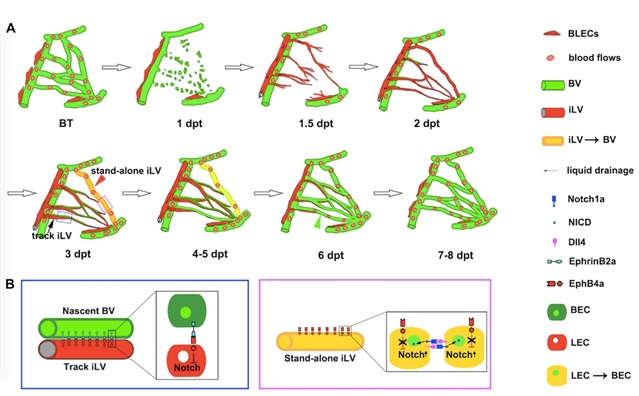
图1:脑血管再生过程及其调控因子
总结起来,罗凌飞组所展示的脑血管再生的细胞进程(包括早期应急再生和晚期全面再生)概括如下(图1A):脑梗或局部脑血管网损伤后,脑膜淋巴管快速响应损伤而生长进入受损脑实质区域,这些内生脑膜淋巴管一方面排出组织液以减缓脑损伤导致的脑水肿;另一方面,大部分内生淋巴管作为生长轨道开始引导新生脑血管沿着其表面生长(我们称为之“轨道淋巴管”)。但与此同时,少部分没有新生血管沿其生长的内生淋巴管(我们称之为“独立淋巴管”)会迅速转分化为应急的早期新生血管以恢复受损脑区的应急血供。排除脑水肿和恢复应急血供是重度脑梗后提高个体存活率的两大要素。个体存活下来后,轨道淋巴管会继续发挥排除脑水肿的作用,同时晚期新生脑血管会继续沿轨道淋巴管生长直至再生完成并完全恢复血流。此时,轨道淋巴管完成使命,从受损脑区凋亡消失,脑实质恢复到无淋巴管的生理状态。
这项研究揭示重度脑梗后最早恢复血供的、对于维持生命至关重要的应急新生血管是由内生脑膜淋巴管转分化形成。未来有望通过EphrinB2/EphB4/Notch信号通路(图1B)作为药物靶点促进脑膜淋巴管转分化以促进脑血管快速再生,为治疗脑梗提供新的途径和思路。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.devcel.2021.09.005