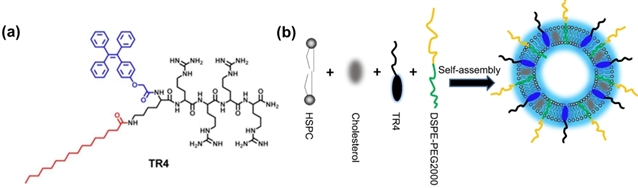
(a) TR4分子结构图;(b) TR4@Lipo阳离子脂质体的结构示意图。
脂质体,特别是阳离子脂质体,是目前应用最广泛的药物/基因递送纳米载体。在血清环境中,脂质体会不可避免地吸附蛋白质等生物分子,形成“蛋白冠”结构。在最近发表于《国家科学评论》(National Science Review, NSR)的文章中,国家纳米科学中心梁兴杰研究团队发现,蛋白冠结构会影响纳米载体的界面性质,使脂质体跨越细胞膜的方式从非能量依赖的膜融合机制转变为能量依赖的内吞机制。
首先,为了可视化示踪阳离子脂质体与细胞膜的相互作用,研究团队设计合成了一种正电性的脂质膜探针TR4分子。TR4分子的结构包含几个部分:棕榈酸链使TR4分子可锚定在磷脂层中;四个精氨酸增加TR4分子水溶性,并将阴离子脂质体反转为阳离子脂质体TR4@Lipo;TPE分子具有聚集诱导发光特性,赋予阳离子脂质体自示踪特性。研究表明,在无血清条件下,TR4@Lipo通过非能量依赖的膜融合方式与细胞膜结合。但是,在人血清、胎牛血清或白蛋白等条件下,细胞主要通过能量依赖的内吞方式摄取TR4@Lipo。研究者对胎牛血清浓度进行调节,发现膜融合过程转变为内吞过程的临界蛋白浓度在0.30%左右。
进一步研究表明,阳离子脂质体的蛋白冠结构还会影响其递送药物分子的亚细胞分布。在无血清条件下,脂质体递送的游离抗肿瘤药物阿霉素(DOX)主要分布于细胞核和溶酶体中,阴离子脂质体递送的DOX主要分布于溶酶体,而TR4@Lipo递送的DOX主要分布于细胞核;在血清条件下,TR4@Lipo递送的DOX主要分布于溶酶体。
本研究报道了蛋白冠对细胞转运阳离子纳米脂质体机制的调控,有助于深入理解复杂生理环境下纳米-生物界面的相互识别和作用机制。同时,该研究对阳离子脂质体的体外和临床应用等具有重要的参考意义。
该项工作得到了国家自然科学基金中爱(NSFC-SFI)国际合作项目、国家自然科学基金中德国际合作项目、国家自然科学基金面上项目、中科院战略性先导专项等项目的支持。(来源:科学网)
相关论文信息:https://doi.org/10.1093/nsr/nwab068
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。