|
|
|
介观活体显微仪器RUSH3D问世—— |
|
脑细胞活动可以“全景式”观看了 |
|
|
作为大脑的重要组成部分,单个脑细胞往往没有意识功能,但当大量脑细胞彼此连接,并互相传递电信号时,意识就有可能产生。如果我们研究意识相关问题,是将视角放在单个细胞内部,还是观察一片区域内众多细胞的活动?
在科学上,如细胞内部这样的尺度被称为“微观尺度”,其与宏观尺度之间的尺度被称为“介观尺度”,对于脑内大量细胞的观察便通常属于介观尺度观察。
伴随着科技进步,目前我们通过超分辨率荧光显微、冷冻电镜等技术,已经可以实现对细胞内部的微观尺度观察,但这类技术所能覆盖的视场极为有限,通常只有1毫米以内;而具有大视场的功能核磁等观测技术,其空间分辨率却远不足以识别单个细胞,这导致研发介观尺度内,兼具大视场与高分辨率的全景式显微技术成为困扰国际科学界的长期前沿难题。
日前,这一难题终于被破解了。
9月13日,中国工程院院士、清华大学自动化系教授戴琼海团队在《细胞》发表最新工作,宣布了新一代介观活体显微仪器RUSH3D系统问世。该系统以前所未有的跨空间和时间的多尺度成像能力,为复杂生物过程的研究提供了全新视角。
 戴琼海(中)和部分团队成员 受访者供图
戴琼海(中)和部分团队成员 受访者供图
不令人满意的“先驱”
戴琼海团队对于介观尺度下的显微成像研究已经有十多年时间。早在2013年,他们便在国家自然科学基金委重大科研仪器研制项目的支持下,在国际上率先进行了探索,并于2018年成功研制了国际首台亿像素实时介观荧光显微仪器——RUSH。
由于兼具厘米级的视场与亚细胞分辨率,并可以在不将细胞从组织内取出的前提下,对细胞进行活体观察,该系统一经推出,便被国际同行誉为介观显微成像领域的先驱。
然而对于这一“先驱”,戴琼海团队自己却并不满意。
“当时的RUSH系统存在很多瓶颈性问题。”戴琼海告诉《中国科学报》,比如,由于系统传感器为二维传感器,无法实现三维成像,但细胞在组织内部的活动却恰恰是三维的;再比如,系统成像需要大量光线照射,这种照射会对细胞产生一定程度的伤害,即所谓“光毒性”。因此,RUSH系统对于细胞活动的高速观察只能持续十几分钟,但某些生命活动的时间跨度却是几个小时甚至更长。
此外,如何克服复杂成像环境导致的光学像差与背景干扰、如何提升弱光条件下的成像信噪比等问题均未得到很好地解决,加之该系统本身造价昂贵,当时仅能被少数科学家使用。
 RUSH系统 受访者供图
RUSH系统 受访者供图
?
“上述每一项技术瓶颈都是生物医学成像领域的国际难题,要想在在同一系统内攻克所有难题,其难度可想而知。”团队成员、清华大学自动化系副教授吴嘉敏说。
面对挑战,戴琼海团队继续开始了一场持续6年的刻苦攻关。这场攻关的最终成果,便是RUSH3D系统的成功问世。
多年攻坚的集成
作为新一代介观活体显微仪器,RUSH3D系统在兼具厘米级三维视场与亚细胞分辨率的同时,还能以20赫兹的高速三维成像速度,实现长达数十小时的连续低光毒性观测。
“相比当前市场上最先进的商业化荧光显微镜,RUSH3D系统在同样分辨率下的成像视场面积提升了近百倍,三维成像速度提升数十倍,光毒性则降低了上百倍,相应地,其有效观测时长也就提升了百倍。”吴嘉敏说,除此之外,其造价也较RUSH系统有了大幅度的降低,“可能只有之前系统的几分之一”,并且具备了量产的能力。
这些成绩的背后,是在此前的6年攻关中,该团队啃下的一个又一个“硬骨头”。
吴嘉敏告诉《中国科学报》,在攻关期间,团队成员针对RUSH系统存在的问题,先后提出扫描光场成像原理、数字自适应光学架构、虚拟扫描算法等数个关键理论与技术,相关成果均发表于《细胞》《自然》等国际顶尖期刊。
比如,针对二维传感器难以捕捉三维动态变化的难题,团队提出的扫描光场成像原理,能在实现轴向400微米范围的高速三维成像的同时,将激光照射对细胞的损伤降低数百倍。
针对活体组织复杂环境引起的光学像差,导致系统成像分辨率与信噪比降低的问题,团队提出了基于波动光学的数字自适应光学架构。在该框架下,无需在光学系统中增加额外设备,在后端即可实现自适应光学像差矫正,从而显著降低系统的尺寸与成本,使得高分辨活体介观显微成像系统变得更加广泛可及。
“可以说,RUSH3D系统集成了过去6年乃至过去十多年来,团队一系列的理论和关键技术创新,才真正实现了整体性能的颠覆性提升。”戴琼海说。
已经展现的“冰山一角”
RUSH3D系统所具有的跨尺度介观成像能力,为哺乳动物复杂生理病理过程的研究提供了全新视角。在该系统的帮助下,戴琼海团队已经取得了多项科研新发现。
比如在对大脑皮层的神经元网络进行观察时,由于观测技术限制,此前的大部分研究只能同时记录观察对象脑部的一个或几个皮层区域的神经元活动,难以进一步研究皮层神经元网络的三维联合动态变化。
然而通过RUSH3D,该团队实现了对清醒小鼠脑部皮层的17个脑区中,十万量级大规模神经元的长时间三维记录。“相关记录证实,响应感觉刺激,调控运动的神经元并非仅存于感觉皮层和运动皮层中,而是广泛存在于皮层各区域。”清华大学基础医学院副教授郭增才说,但各区域神经元对感觉信息的编码、整合和区分能力存在差异。
该团队还首次观测到了观察对象遭受急性脑损伤后,其多脑区的免疫反应,并发现了大量中性粒细胞从非血管区域向脑内的迁移与回流过程。在对小鼠免疫反应过程的观察中,团队同时观测到淋巴结内多个生发中心的形成过程,以及T细胞在不同生发中心间的迁移现象。
“这些初步实验虽然仅展现了RUSH3D应用的冰山一角,但已经充分展示了其给神经科学、免疫学、肿瘤学、药学等领域前沿研究所带来的广阔应用前景。”论文共同第一作者、清华大学自动化系博士后张元龙说。
除进行相关研究外,基于该系列成果的核心专利已转化成立了实体化企业,致力于国产自主可控、具备国际领先性能的高端光学显微镜,以及其在相关领域的前沿应用。其产品已支撑清华大学、北京大学、解放军总医院等多家国内高水平科研机构,在肿瘤学、免疫学、脑科学等不同领域开展了20余项创新性
研究。
相关论文链接:https://doi.org/10.1016/j.cell.2024.08.026
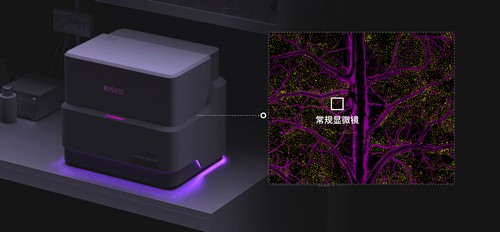 RUSH3D,超大三维成像视场覆盖小鼠皮层(相当于100台显微镜同时拍摄) 受访者供图
RUSH3D,超大三维成像视场覆盖小鼠皮层(相当于100台显微镜同时拍摄) 受访者供图
?
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。