中山大学肿瘤防治中心教授元云飞/李斌奎团队与美国得克萨斯大学安德森癌症中心教授Dr.Guocan Wang合作,研究发现蛋白质精氨酸甲基转移酶3(PRMT3)是介导肝癌免疫治疗抵抗的关键基因,PRMT3可作为预测肝癌免疫治疗疗效生物标志物和克服肝癌免疫治疗耐药的潜在的治疗靶点。相关成果近日在线发表于《自然-通讯》(Nature Communications)。
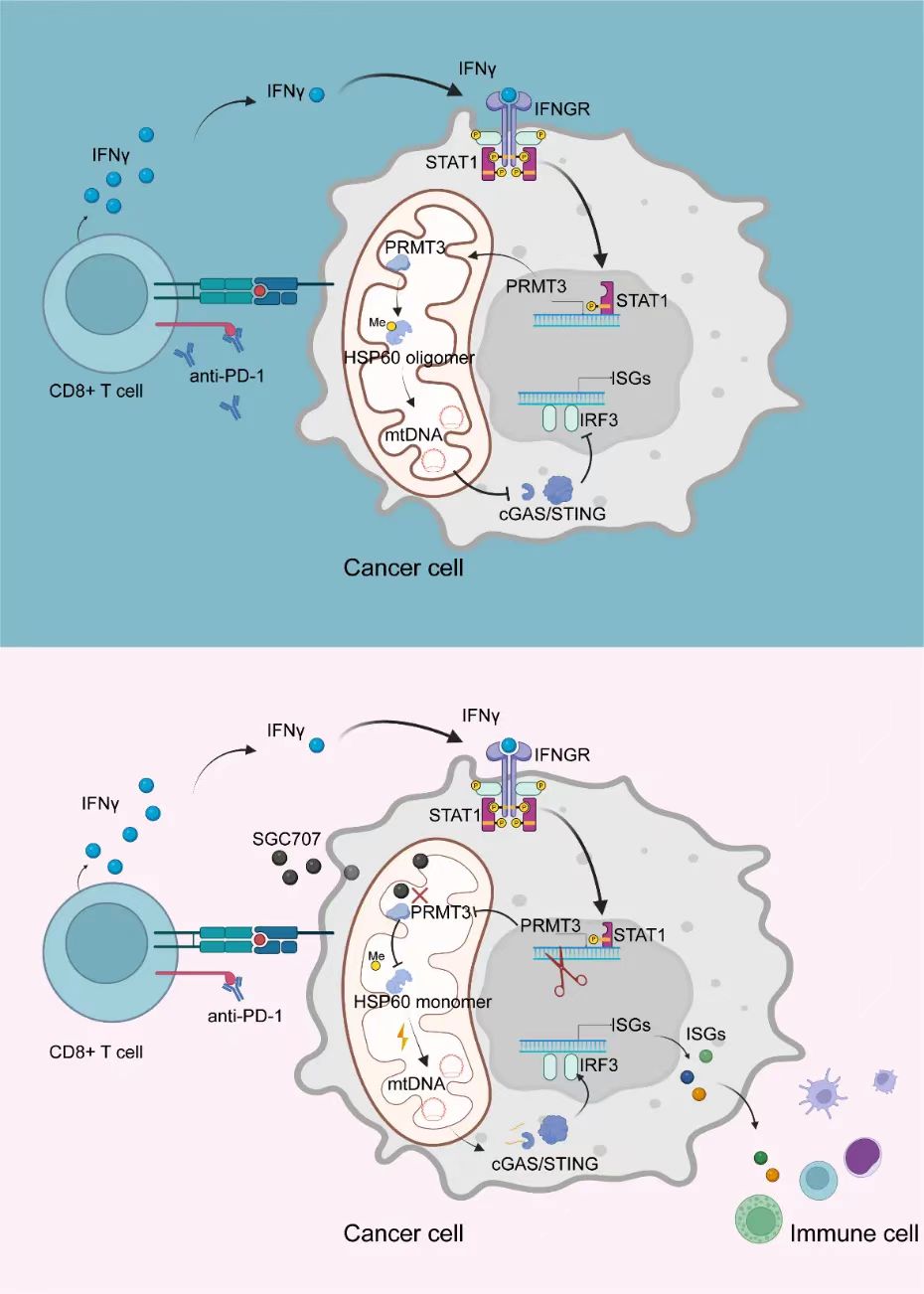 研究结果模式图。研究团队供图
研究结果模式图。研究团队供图
?
“该研究成果为临床筛选肝癌免疫治疗获益人群,以及逆转免疫治疗耐药提供了新思路。”论文共同通讯作者元云飞表示,免疫治疗具有持久反应的潜力,但由于原发性耐药,只有约20%的肝癌患者从免疫治疗中受益。此外,那些最初对治疗有反应的患者可能会对免疫检查点阻断产生获得性耐药。
元云飞/李斌奎团队多年致力于探索表观修饰在肝癌发生发展及治疗抵抗中的作用。该团队前期研究发现PRMT3是介导肝癌奥沙利铂耐药的关键基因,PRMT3非对称二甲基化修饰IGF2BP1 452位精氨酸位点,促进其作为m6A reader的功能,通过维持HEG1的稳定性促进奥沙利铂抵抗。此外,PRMT3可前瞻性预测肝癌患者肝动脉灌注化疗的疗效。
为进一步探索驱动肝癌免疫治疗抵抗的关键表观修饰蛋白,该团队通过整合癌症基因组图谱数据库转录组学数据以及免疫浸润水平,结合生存分析、多重免疫组化,肝癌患者临床样本验证等方法,发现精氨酸甲基转移酶PRMT3同样在肝癌免疫治疗抵抗中发挥重要作用。
研究团队通过多种体内模型证实PRMT3高表达显著地促进肝癌免疫治疗抵抗。为进一步探索其机制,团队通过质谱分析发现线粒体蛋白HSP60是PRMT3的底物之一。PRMT3通过对HSP60的446位精氨酸进行非对称双甲基化修饰,促进其多聚化,进而维持其作为线粒体稳态调节蛋白的功能。靶向PRMT3与PD-1单抗在肝癌小鼠模型中显示协同作用。
有趣的是,研究还发现PRMT3在接受免疫治疗的患者中表达水平更高,进一步探索发现免疫治疗诱导CD8+T细胞激活,释放干扰素-γ,激活肿瘤细胞IFNGR1-STAT1信号通路转录调控PRMT3。诱导上调的PRMT3反过来又可以促进免疫抑制微环境形成,抵抗免疫治疗的杀伤作用。这可以看做是肿瘤细胞在面对免疫杀伤的过程中进化出的一种自我保护机制。
论文共同第一作者、中山大学肿瘤防治中心博士生施云星表示,为进一步探究临床应用价值,团队还分析了PRMT3与肝癌免疫治疗疗效的相关性,结果表明肝癌患者在治疗前的PRMT3表达水平与肝癌免疫治疗的治疗反应紧密相关。PRMT3高表达的肝癌患者对免疫治疗的客观缓解率显著低于PRMT3低表达的患者。研究表明,PRMT3可以作为免疫治疗疗效的潜在生物标志物。
该研究发现,PRMT3是肝癌免疫治疗抵抗的关键基因,从分子水平、细胞层面、动物模型等方面,阐明了PRMT3通过甲基化修饰HSP60446位精氨酸促进免疫治疗抵抗的分子机制;并且发现免疫治疗可上调PRMT3表达水平这一肿瘤细胞的自我保护机制。
论文共同通讯作者、中山大学肿瘤防治中心主任医师李斌奎表示,该研究成果对于临床上提高肝癌免疫治疗疗效、制定治疗决策及个体化治疗具有重要意义。
相关论文信息:https://doi.org/10.1038/s41467-024-52170-3
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。