|
|
| 上海交大邓子新团队合作揭示聚酮合酶的C-N键形成机制 |
|
近日,上海交通大学 技术学院、微生物代谢国家重点实验室邓子新团队合作于《自然通讯》(Nature Communications)杂志上发表题为 “聚酮合酶的碳-氮键形成”(C-N bond formation by a polyketide synthase)的研究论文。上海交大博士后王嘉良、上海佶凯星生物科技有限公司汪小杰、上海交大硕士李希希、国家蛋白质科学中心(上海)孔亮亮、上海交大硕士生杜泽乾和博士生李丹丹为该论文共同第一作者。上海交大林双君教授、石婷研究员、邓子新教授、汪志军副研究员和梁晶丹副研究员为共同通讯作者。
该工作通过组合分子遗传学、结构生物学、生物化学和分子动力学模拟等多种技术手段,鉴定并重构钙霉素合成途径中聚酮合酶CalA3催化的C-N键形成现象,解析CalA3与底物、产物的高分辨复合物三维结构,深入推动次生代谢巨型蛋白质机器的生物化学与结构研究,为理解聚酮合酶新颖的C-N键形成机理、衍生新型药物提供理论基础。
聚酮合酶(PKSs)是自然界中一系列强大的多功能酶,能够合成具有广泛生物活性的天然产物,包括:抗生素,降胆固醇药,抗肿瘤药以及免疫抑制剂。由于其具有功能多样、结构复杂等特点,探究PKSs的基本催化机制一直是微生物天然产物合成,进而衍生新型药物的研究焦点之一。
通常情况下,聚酮合酶遵守着相同的基本合成原理:催化C-C键的形成。然而,在抗生素钙霉素合成途径的聚酮链释放步骤,存在一种潜在的、未被鉴定的C-N键形成现象。关键的科学问题亟待进一步回答:(1)哪个酶负责催化C-N键的形成?该酶整体组织架构怎样,与其家族成员有何异同?(2)经典的形成C-C键的聚酮合酶如何催化C-N键的形成?(3)关键结构域、活性位点氨基酸如何进行底物的识别、缩合以及聚酮链终产物的释放?
针对上述关键性问题,研究人员首先通过体内敲除实验,论证了聚酮合酶CalA3负责催化钙霉素聚酮链释放步骤中C-N键的形成。随后运用冷冻电子显微镜单颗粒分析技术,成功解析3.38 ?的CalA3高分辨结构(图1)。CalA3整体呈现“∞”型的二体构架,分为上、下两个部分。上半部分“结构区”,包含DH-KR(脱水酶-酮还原酶)结构域,下半部分“催化区”,包含DD-KS-AT(对接-酮脂酰合酶-乙酰转移酶)结构域。

图1. 聚酮合酶CalA3的整体构架
结构高度对称的CalA3上、下两个区域紧密相互作用,互作面积达到~2842 ?2(图2)。DD结构域呈现水平、垂直的两种截然不同的构象;AT、DH、KR结构域由于缺失活性位点氨基酸、或底物通道被堵塞、或辅因子结合序列丢失等原因,无法执行其应有的功能。它们组成了一个分子量巨大的“盖子”,以非酶促的方式起到稳定整个蛋白质结构的作用。
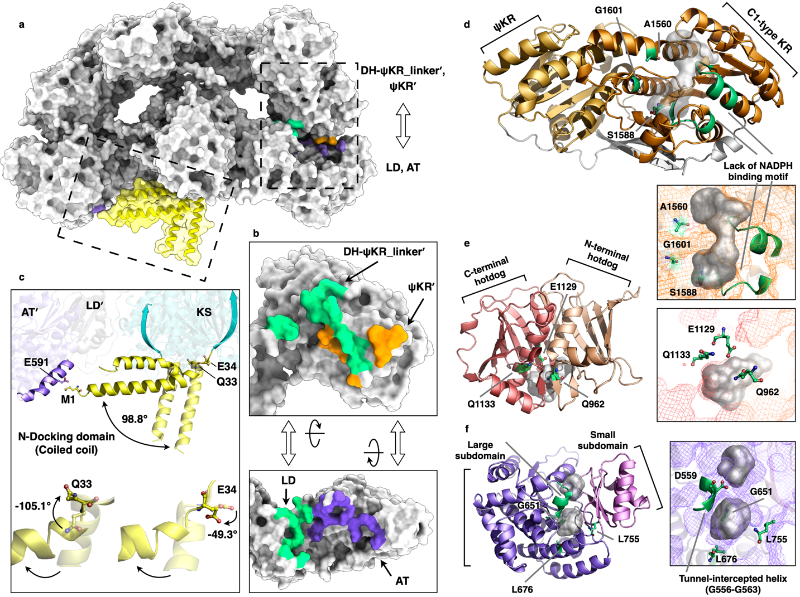
图2. 结构域间的相互作用以及非酶结构域的特征
CalA3真正的催化活性隐藏在KS结构域里(图3)。通过体外重构成功鉴定了KS结构域催化聚酮链模拟底物SNAC-N1与辅因子3-HAA(三羟基邻氨基苯甲酸)之间的缩合反应,核磁共振确定了形成C-N键或水解并被释放的两个终产物的化学结构;点突变测活锁定了关键的活性位点氨基酸C197-H332-H372催化三联体。
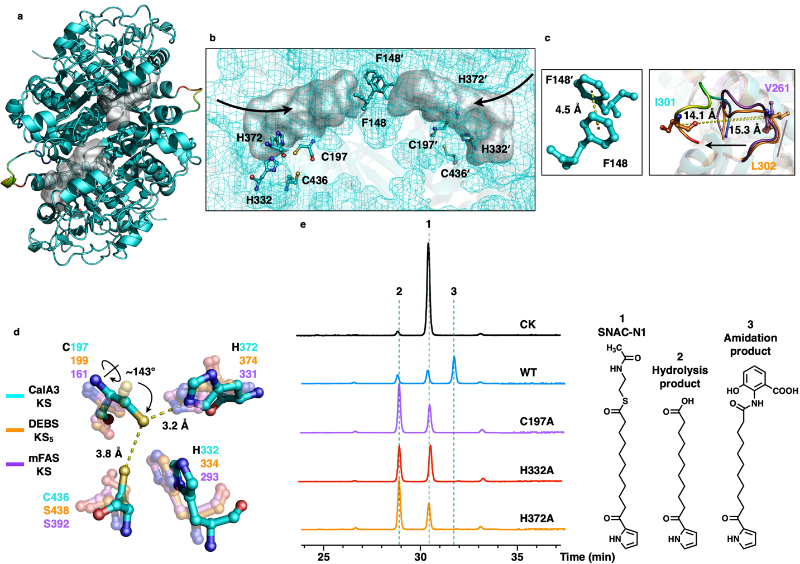
图3. CalA3 KS结构域的结构与功能
为深入探究CalA3-KS的C-N键催化机制,通过分子动力学模拟对催化过程进行了初步的预测;运用冷冻电镜进一步捕获了CalA3与两种终产物的高分辨复合物结构(图4),最终揭示了CalA3-KS的精确催化机制:在聚酮链进入KS的底物通道后,C197对其硫酯键发动亲核攻击,形成酰化状态。H332从辅因子3-HAA的氨基上获取一个氢,作为广义碱再次发动亲核攻击,最终形成C-N键并释放终产物或通过水解反应释放终产物。此外,在形成碳四面体中间产物时,H372、K367、L437和L439巧妙地稳定了辅因子3-HAA,起定位作用。
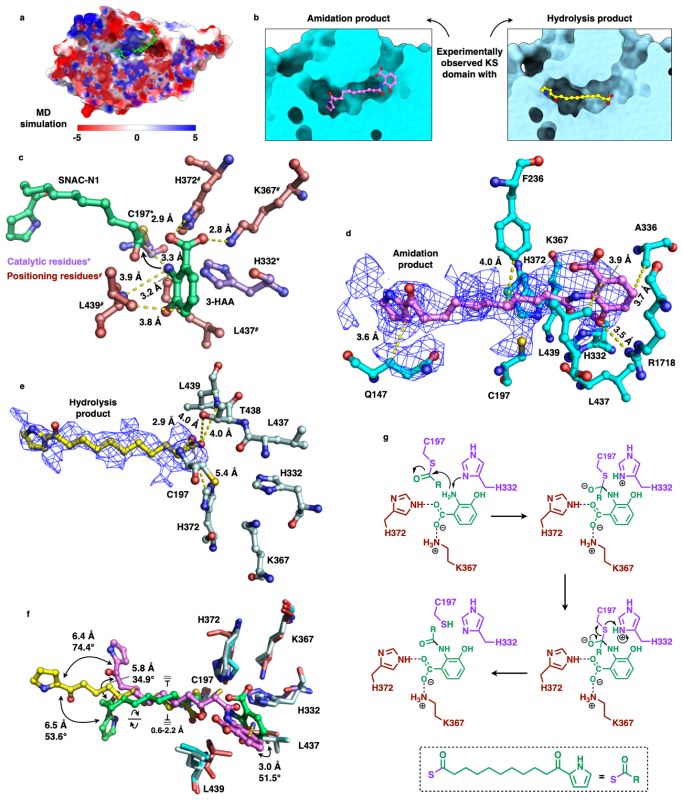
图4. CalA3 KS结构域的催化机制
CalA3紧致并高度对称的整体构架与其家族的其他PKSs差异巨大。通过人工智能AlphaFold2预测了合成雷帕霉素、FK-506以及两性霉素的16个PKSs的完整结构(图5)。与CalA3相反,这些PKSs通过结构的动态摇摆、创造非对称的催化腔体,实现上述免疫抑制剂和抗生素的生物合成。
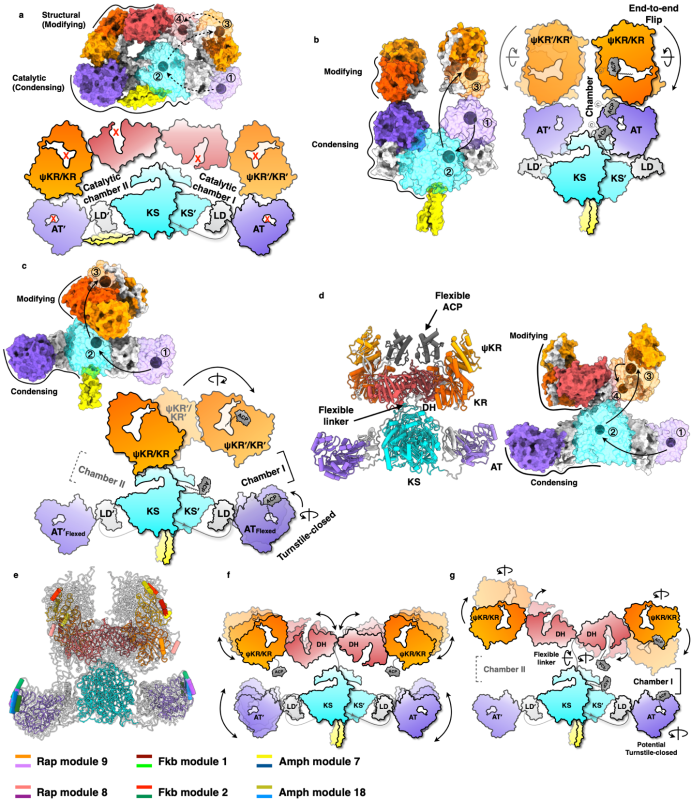
图5. CalA3与功能性聚酮合酶的构架对比及预测
综上所述,研究人员解析了一个拥有罕见构架的聚酮合酶CalA3的完整结构,揭示CalA3催化的C-N键的形成机制。关键的“催化”氨基酸与“定位”氨基酸通力合作,实现新颖的C-N键的形成和终产物的释放。CalA3与同家族PKSs的细致结构对比,则为工程化改造聚酮合酶,合成创新药物提供重要的基础理论依据。
华北理工大学副教授苟丽霞、上海交大博士吴昊、博士生曹卫、博士后王晓政参与了该项工作。感谢国家蛋白质中心王芳芳、辛立辉、李光一、段佳琳、刘娜等老师的技术支持。感谢上海交通大学超算中心π 2.0集群提供的平台及技术支持。
该研究得到了国家重点研究发展计划、国家自然科学基金、国家博士后科学基金以及上海市超级博士后激励计划的经费支持。
论文链接:https://www.nature.com/articles/s41467-023-36989-w
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。