糖尿病成为世界范围常见的一种慢性炎症性疾病,糖尿病的发病率逐年升高,相关研究一直是
领域的热点。
日前一份关于糖尿病机理的研究,提示了胰高血糖素样肽-1(GLP1)与细胞因子白介素18(IL18)对他们相应受体的协同作用。
并且IL18与GLP1具有完全相同的抗糖尿病的功能, 即通过激活IL18信号通路,达到改善糖尿病或高血糖症导致的胰岛β细胞减少和胰腺炎症的可能性,缺失GLP1或IL18的信号都将导致糖尿病灶的发生发展。
相关文章《IL18信号通过腺泡和胰岛β细胞上的不同受体促进β细胞发育和胰岛素分泌》为糖尿病的治疗提供了全新的靶向目标和思路。《细胞》子刊《发育细胞》6月20日在线刊发该文。
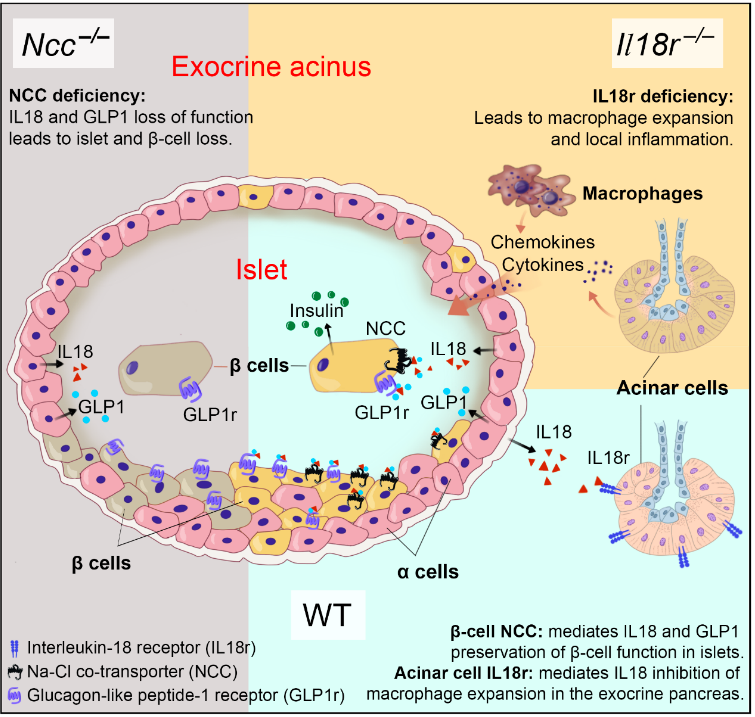
GLP1和IL18在胰腺中的协同作用示意图(受访者供图)
IL18r、NCC具有相同动力学表现和亲和力
1型、2型糖尿病(T1D、T2D)病因不同,但共同特征表现为胰岛β细胞的存活失调和和胰岛素分泌的下降,新β细胞补充不足。因此,从其他细胞类型(如胰岛α细胞)再生β细胞已被认为是糖尿病的潜在治疗策略。
上述文章共同通讯作者之一、哈佛大学医学院施国平教授告诉《中国科学报》, 炎症被认为与糖尿病的发生发展有关, IL18则是常见的炎症标记物,可于免疫细胞和脂肪细胞等细胞中表达,而糖尿病人循环IL18水平显著高于正常个体。
既往研究表明,IL18r是IL18的经典受体。施国平团队则于2015年首次报道了曾被认为是肾脏独有的钠氯共转运蛋白(Na-Cl co-transporter,NCC)可作为IL18的另一受体,并与IL18r发挥协同作用,二者对IL18具有相同的动力学表现和亲和力。
定义炎症因子IL18与受体新关系
IL18r、NCC在胰腺中是否表达,IL18是否通过这二者调控胰岛素分泌进而影响糖尿病的发生发展,仍有待探明。
施国平与合肥工业大学食品与生物工程学院副教授张弦,郑州大学第一附属医院教授刘章锁和海南医学院第一附属医院教授郭峻莉等对此展开研究。
他们发现,在人和小鼠的胰腺中,胰岛α细胞表达IL18,胰腺外分泌组织中的腺泡细胞表达传统的IL18受体IL18r,胰岛β细胞则表达NCC。
其研究结果表明,IL18通过这两种受体,调控胰腺外分泌组织炎症反应和胰腺β细胞凋亡,促进β细胞发育、增殖和胰岛素分泌。也就是说,“IL18及其受体IL18r和NCC具有保护β细胞功能、改善T1D和T2D的细胞特异性活性”。施国平解释道。
《发育细胞》几位审稿人一致认为,这篇论文定义了细胞因子IL18与其受体IL18r、NCC之间的新关系,信息量颇大, 对T1D和T2D以及β细胞的发育会有重要的影响。
IL18与GLP1抗糖尿病功能完全相同
施国平强调了他们研究中的另一项重要发现,即IL18 与同是来自胰岛α细胞的的GLP1, 共同作用于β细胞上的NCC和GLP1r(即GLP1受体),驱动β细胞发育、胰岛素分泌和胰岛素信号传导。缺失NCC或GLP1r其中任何一个受体 ,GLP1 和IL18都将失去功效。
GLP1受体激动剂(GLP1r agonists),例如艾塞那肽、利拉鲁肽、思美格鲁利西塞那肽、阿必鲁肽、杜拉鲁肽、和索玛鲁肽等,近年来作为一线降糖药,特别是对妊娠期糖尿病高血糖症患者,比二甲双胍或格列本脲更加适合。与之一样,IL18可能对肥胖和糖尿病患者具有治疗潜力。
然而,在实验模型中,中断IL18与其受体的相互作用已被证明将有效减少动脉粥样硬化。因此,在心血管疾病患者中靶向IL18可能会损害β细胞功能。“通俗点儿说,IL18对冠心病是坏因子,却对糖尿病是好因子。”
那么GLP1激动剂呢?根据施国平向临床同事征询的结果,却并不对心血管疾病患者产生负面作用。这也使他明确了后续的研究方向。
“这些发现为IL18信号在调节胰腺β细胞增殖中的作用提供了深入的思路,并可能有助于指导未来保护这些IL18通路的努力,作为糖尿病患者扩大β细胞和增加胰岛质量的潜在策略。”施国平表示。
相关论文信息:https://doi.org/10.1016/j.devcel.2022.05.013
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。