|
|
| 巧用“信号兵” 拓荒“处女地” |
| 研究首次阐明黏附类受体自发激活分子机制 |
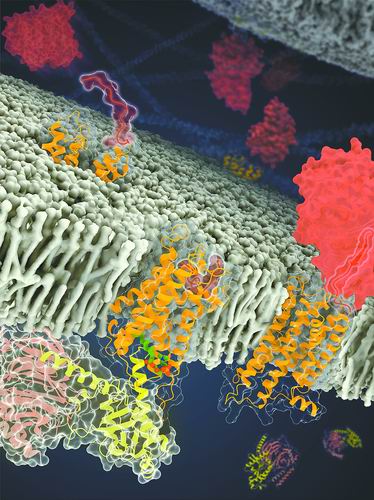
黏附类受体结构示意图受访者供图
■本报记者 张双虎
G蛋白偶联受体(GPCR)就像细胞膜上的“信号兵”,接收并将外来信号(如小分子、激素、光子、蛋白质等)传递到细胞内,“告诉”细胞应该做出什么反应,并以此调控人体各类生命活动。这一过程也被称为信号转导。
近日,中国科学院上海药物研究所研究员吴蓓丽、赵强研究组联合上海科技大学研究员水雯箐研究组,在孤儿受体信号转导机制研究方面取得突破。该联合团队成功解析两种黏附类GPCR(ADGRD1和ADGRF1)分别与G蛋白结合的复合物三维结构,并开展了功能相关性研究,首次阐明这类孤儿受体自发激活的分子机制,为研究该类受体的信号转导机理和未来药物设计提供了重要依据。
4月13日,相关研究在《自然》发表。
受体研究是药物研发的“源泉”
在正常生理状态下,受体把信号传递到细胞内,行使其生物学功能:在心血管系统中调节血压,在神经系统中调节神经元。比如在心血管系统中发挥作用的肾上腺素受体,在神经系统中发挥功能的多巴胺受体,包括人们看到颜色、嗅到气味都需要通过受体识别、传导信息才能实现。
“我们以前研究过一些和血栓性疾病相关的受体。它发挥作用后,血小板就会凝集,这可以用来防御血管损伤。”吴蓓丽对《中国科学报》说,“如果在非正常状态下,受体在不该‘活跃’的时候‘活跃’了,就会在血管里形成栓块,引发血栓性疾病。”
因此,研究GPCR的结构和功能,对新药研发意义重大。在治疗疾病时,人们可以利用药物分子跟靶点受体结合,激活或抑制受体,从而发挥治疗作用。
吴蓓丽解释说,在新药研发方面,要确认受体是否是某种疾病的药物靶点,首先要明确它是否参与或导致疾病发生、在疾病出现和发展过程中发挥怎样的作用。然后针对这种疾病,决定是激活受体的功能,还是抑制它的作用。
GPCR在细胞信号转导中发挥重要作用,并与众多疾病密切相关,因此,它成为最大的药物靶标蛋白家族,围绕GPCR的药物研发也成为国际医药产业的竞争高地。目前有超过40%的上市药物通过与这些受体作用发挥疗效,但仍有大量该家族的靶向药物处于研发阶段。孤儿受体作为潜在药物靶标的“源泉”,给创新药物研发带来机遇。
7年没有“正反馈”
GPCR是个庞大的蛋白家族,目前人们已知的有800多种,其中约100多种是“孤儿受体”。
“所谓‘孤儿受体’,就是与它结合的配体、信号和信号转导通路都不清楚,人们对这类受体的功能了解非常少。”吴蓓丽介绍说,“目前,黏附类受体共33种,针对其中个别受体的研究发现,某些受体可能与精神分裂症、多动症或癌症相关。”
到目前为止,科学家只是发现在某种疾病发生时,有受体通过某些方式参与其中,但它究竟如何导致疾病发生,在疾病发展中又起到什么作用,尚不清楚。
和其他GPCR相比,黏附类受体的分子结构复杂且构成不稳定。不管是空间结构还是氨基酸序列,不同黏附类受体之间的相似性很低,“如果单从氨基酸序列上,很难想象这类受体到底通过什么方式发挥作用”。
此外,在结构和功能研究中,受体的配体(和受体结合的蛋白、化合物等)也非常重要。人们解析受体结构过程中,需要用配体分子来稳定受体,但孤儿受体的配体至今仍不清楚,并且信号通路不明,在什么情况下处于活化状态也未知,这让孤儿受体研究“缺少必要的手段”。
“人们对黏附类受体功能调控机制、相互作用网络和药理基础等方面的认识远远落后于其他 GPCR 家族,其中大部分仍然是孤儿受体。”上海科技大学iHuman研究所执行所长刘志杰说。
由于已知信息很少,国际上可借鉴的研究有限,再加上黏附类受体独具的特异性,大大增加了该项研究的难度。
“这项研究摸索了7年,有五六年时间都不知道所走的路对不对。”吴蓓丽说,“我们做一件事时,总是需要一些‘正反馈’,哪怕只是阶段性成果。但在这项研究中,我们该试的、该做的都做了,就是看不到结果。”
7年没有“正反馈”,对一个研究团队,尤其是团队的年轻人来说非常“残酷”。有人因此冒出放弃的念头。吴蓓丽也一度很焦虑,她经常反问自己“选的这个方向、这个研究侧重点究竟对不对”。
“我一次次鼓励他们,其实也是给自己‘打气’。”吴蓓丽说,“近几年,GPCR的结构和功能研究,包括药物研发方面发展非常快,人们对这个家族的了解不断加深,但黏附类受体是这个家族里发展最慢的,可谓是一块‘处女地’。我们想到会有挑战,但没料到挑战竟如此艰巨。”
发现孤儿受体的独特性
转机终于在2021年出现了。
在充满不确定性的探索中,团队逐步有了自己的积累,再加上技术、方法和仪器各方面的不断进步,配体研究也有了长足的发展。团队找到一段多肽作为配体,并通过测定ADGRD1和ADGRF1分别与G蛋白结合的复合物结构,发现受体自身的一部分可作为内源性激动剂。
“这个充当激动剂的部分是位于受体胞外结构域和跨膜结构域之间的一段多肽。”论文共同第一作者、中国科学院上海药物研究所博士生瞿向利说,“该区段通过与受体跨膜结构域作用,导致跨膜螺旋发生构象变化,从而激活受体,使其与G蛋白结合。这种受体自发激活方式从未在其他类型GPCR中发现,这体现了黏附类受体信号转导机制的独特性。”
此外,该研究还发现一种天然脂分子通过与ADGRF1特异性结合对受体功能进行调控。团队在ADGRF1与G蛋白的复合物结构中,还发现一个脂分子与受体中G蛋白结合口袋附近的一个位点结合,而在另一个受体ADGRD1的结构中则没有发现脂分子。
研究人员利用质谱与组学技术鉴定该脂分子的结构为溶血磷脂胆碱(LPC)。进一步研究表明,LPC可能通过稳定受体胞内侧区域的构象促进受体激活。这是首次发现细胞膜的脂质成分LPC与GPCR结合并对受体功能发挥调控作用。
“这项研究极大拓展了我们对黏附类受体信号转导和功能调控机制的认知。”刘志杰说,“这对于后续功能研究和药物研发将产生重要影响。”
该论文审稿人认为,该研究深入分析受体的激活机制和对效应蛋白的识别机制,“为理解黏附类GPCR的结构与功能关系提供了全面的信息”。
“取得上述突破性成果源于该团队在GPCR研究领域十余年来的积累和对该领域核心问题持之以恒的探索。”复旦大学教授徐彦辉评价说,“这些研究充分体现黏附类GPCR信号转导和调控机制的独特性、复杂性和多样性,促进对这类受体分子机制的理解,为研究大量结构、功能未知的孤儿受体提供了新思路,也为挖掘其药物研发潜力提供了新线索。”
相关论文信息:
https://doi.org/10.1038/s41586-022-04580-w
《中国科学报》 (2022-04-14 第1版 要闻)