导读
在细胞生理功能调控的前沿探索中,光因其独特的清洁性、非侵入性以及时空精确性等特质,成为调控活细胞内多种生化进程的理想媒介。然而,细胞自身对光的敏感性匮乏,促使科学界不懈追寻赋予细胞光响应能力的有效策略。在此征程中,光致变色换能器领域的偶氮苯(ABs)备受瞩目,其稳定态与亚稳态间的异构化反应,为光控蛋白质、核酸及离子通道活性开启了新路径。但 ABs 在生物兼容性、光谱适配性、开关特性优化及靶向精准度提升等方面的瓶颈,限制了其进一步发展。
近日,意大利米兰理工大学和意大利技术研究院的科研团队引入了一种膜靶向推拉型偶氮苯(MTs)家族,为细胞刺激技术带来了新的曙光。这类创新分子凭借卓越的水溶性,可自主嵌入细胞膜磷脂双分子层,构筑起光与细胞间的关键交互桥梁。在光照激发下,MTs 从反式至顺式的异构转变高效引发,重塑局部电荷分布格局,进而精准驱动细胞应答,诱导膜电位呈现清晰、稳定且可复现的去极化态势。研究团队经严谨筛选,聚焦明星分子 MTP2,运用光学光谱前沿技术,深度解析其在膜环境中的光物理特性与激发态演化。MTs 的问世,将引领细胞功能调控迈向精准化、高效化新征程。
该文章近日发表在国际顶尖学术期刊《Light: Science & Applications》,题为“Membrane-targeted push-pull azobenzenes for the optical modulation of membrane potential”,意大利米兰理工大学的Chiara Bertarelli教授和意大利技术研究院的Guglielmo Lanzani教授为论文的共同通讯作者,Valentina Sesti为论文的第一作者。
研究背景
在细胞功能精准调控的探索中,光以其卓越特质被视作理想工具,却因细胞自身光敏感性匮乏而难以施展。偶氮苯(ABs)虽为光刺激研究焦点,但其异构化应用仍困于多重难题。于生物兼容性而言,ABs 难以与生物体系和谐共生,易扰乱细胞代谢节奏与生理稳态,阻碍细胞功能正常运转。光谱响应方面,现有 ABs 光谱范围与生物需求适配欠佳,致使光刺激精准度受损,限制其对细胞功能的精准激活与调控效能。开关特性上,ABs 存在切换迟缓及不完全等瑕疵,难以及时、精准地把控细胞活性调节进程,无法满足细胞动态功能变化需求。细胞区室靶向精准度不足,令其在细胞内刺激定位模糊,无法高效作用于关键功能位点,降低功能调控效率。
传统基于 ABs 的光刺激方案多依赖工程设计,虽赋予蛋白光敏感性,却衍生诸多困境。在负对比信息获取上,现有光开关化合物能力薄弱,极大限制生物成像深度与功能细节捕捉,难以构建细胞微观结构清晰图谱及解析动态机制。侵入性问题严峻,其与细胞活性成分直接作用易引发细胞内环境失衡,触发应激反应甚至损伤细胞结构与功能完整性,严重阻碍临床转化进程,使光刺激技术在实际应用中受限。
分子光致动器虽为创新方向,可自发嵌入细胞膜传导光刺激,但现有分子如 Ziapin2 仍存关键缺陷。水溶性不佳使其在生物介质中分散性差、稳定性低,导致光刺激效果波动,干扰实验重复性与应用可靠性。缺乏明确、高效的开/关切换机制,致使光刺激时机与时长难以精准把控,无法灵活适配细胞复杂生理节律及功能调节需求。黑暗条件下,Ziapin2 对细胞膜稳态干扰显著,引发膜厚度异常及非预期生物事件,扰乱细胞正常电生理与信号传导秩序,阻碍其成为优质光刺激工具,凸显新型分子开发的迫切性。
创新研究
该研究成功设计并合成了膜靶向推拉型偶氮苯(MTs)家族,以独特的化学结构设计克服传统偶氮苯(ABs)的诸多局限。通过引入强吸电子的NO2基团和含阳离子基团的烷基链,实现了对分子性能的多维度优化。经严格筛选确定的 MTP2分子表现出卓越的水溶性(如图1),这一特性有效解决了传统ABs水溶性差的问题,使其在生物环境中的应用更为广泛。同时,MTP2具有更高的反-顺异构化速率,响应速度更快、效率更高,显著提升了光刺激的及时性和有效性。此外,MTP2在黑暗状态下保持惰性,避免了如先前研究中类似分子在黑暗条件下对细胞膜的自发扰动,确保了细胞环境的稳定性。这种分子设计上的创新为细胞光刺激技术提供了更理想的分子工具,为后续研究奠定了坚实基础。
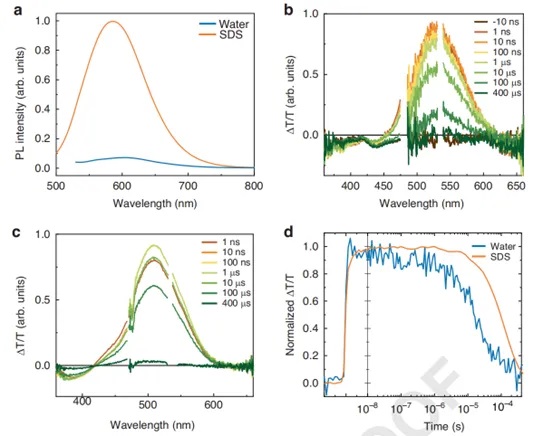
图1. MTP2 在水和 SDS 胶束悬浮液中的稳态和瞬态光谱
此外,研究团队运用先进的光学光谱技术与精细的分子动力学模拟相结合的方法,对 MTP2 分子进行了全面深入的研究。在光物理特性方面,稳态和瞬态光谱技术的应用揭示了MTP2在不同环境中的光吸收、发射及电荷转移特性,深入阐释了溶剂极性对分子能级结构和光物理过程的影响机制,极大地丰富了对推拉型偶氮苯光物理性质的理解。如图2,分子动力学模拟则精确呈现了MTP2分子在细胞膜内的自发插入、稳定分布以及与膜脂质分子的相互作用细节,明确了其在膜内的取向和运动行为,证实了MTP2对细胞膜结构无显著影响,这与传统分子如Ziapin2 形成鲜明对比。这些研究成果填补了此前在光刺激分子与细胞膜微观相互作用机制方面的认知空白,为深入理解细胞光刺激的物理化学过程提供了关键依据。
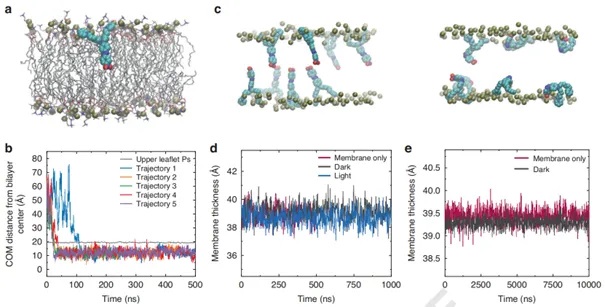
图2. MTP2 自发分配到脂质双层中
研究明确了 MTP2 分子在光刺激下,其偶极矩的变化是驱动离子跨膜重新分布从而改变膜电位的关键因素。基于这一核心机制,创新性地构建了数学模型,该模型巧妙地将 MTP2 的光异构化动力学过程与膜电位的动态调控紧密联系起来,成功地重现了在不同光强度下细胞膜电位随时间的演变过程,通过图 3 可直观看到模型对膜电位变化的模拟与实验数据对比,理论与实验观测数据高度吻合,充分验证了模型的准确性和可靠性。
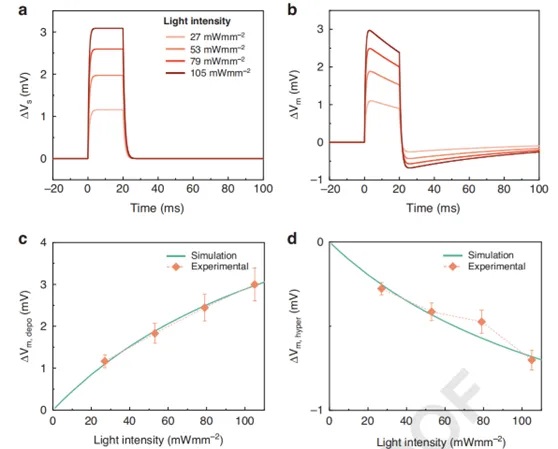
图3. 再现 MTP2 调控膜电位时间演化的数学模型
总结与展望
本研究成功引入膜靶向推拉型偶氮苯(MTs)作为新型细胞光刺激工具,尤其聚焦于MTP2分子的研究。通过系统实验评估,MTP2在多个方面展现出卓越性能。其水溶性良好,可有效分散于生物环境中,利于与细胞膜相互作用;反 -顺异构化速率高,能够快速响应光刺激,实现高效的细胞电位调节;在黑暗中呈惰性,避免对细胞造成不必要干扰。在多种细胞模型中的实验表明,MTP2可诱导稳定且可重复的膜电位去极化,且对细胞生理特性影响极小,为细胞生理功能的精准调控提供了可靠手段,极大地丰富了细胞光刺激技术的工具箱。
展望未来,研究将聚焦于多个关键方向推进。在分子设计上,致力于进一步优化MTs分子结构,提高其对膜电位调控的敏感性和特异性。仪器设备方面,不断探索创新拉曼仪器的设计与改进,提升光刺激的精准度、分辨率和效率,同时降低成本,推动其在更广泛科研场景中的普及。成像窗口选择上,积极探索利用NIR- II窗口的潜力,克服现有技术难题,实现更深层次组织成像与更精准细胞功能监测。此外,大力推动技术标准化工作,加强与其他成像模态的融合及计算技术辅助应用,通过跨学科合作,综合多学科优势,实现从基础研究到临床应用的转化,最终实现个性化医疗与精准治疗的宏伟目标。(来源:LightScienceApplications微信公众号)
相关论文信息:https://doi.org/10.1038/s41377-024-01669-x
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。