|
|
| 氧化石墨烯抗原呈递平台仿生细胞刺激助力T细胞免疫疗法 |
|
嵌合抗原受体(chimeric antigen receptor, CAR)改造的T细胞是癌症治疗的前沿疗法。然而,现有的CAR T细胞生产方案并不能有效模拟免疫突触以获得最佳的免疫刺激和产出。为突破这一局限性,美国加州大学洛杉矶分校的黄昱教授和杨莉莉教授开发了一种柔性的氧化石墨烯抗原呈递平台(graphene oxide antigen-presenting platform, GO-APP),通过将抗体固定在氧化石墨烯上来实现抗原呈递,很好地模拟了体内抗原呈递细胞(antigen presenting cell, APC)与T细胞之间的免疫突触,大幅提高了T细胞的激活与增殖,还同时保持了其细胞因子分泌的多功能性和杀伤癌细胞的高效性。在CAR-T生产过程中,GO-APP 能提高CAR基因在T细胞中的导入效率,并使CAR T细胞的产量比标准方案增加了五倍以上。另外,GO-APP还能诱导T细胞自分泌大量白介素-2(IL-2),这就消除了惯常T细胞培养对外源性IL-2的依赖,为无外源IL-2培养T细胞提供了新途径。
相关成果“Biomimetic cell stimulation with a graphene oxide antigen-presenting platform for developing T cell-based therapies”发表在2024年9月23日的Nature Nanotechnology期刊上。论文通讯作者是黄昱教授和杨莉莉教授,第一作者是朱恩博博士和虞家霁博士。
T细胞免疫疗法是一项突破性抗癌技术,其中CAR-T细胞疗法自2017年获得美国食品药品监管局(FDA)批准以来,以其优异的疗效开启了癌症治疗的新纪元。CAR-T疗法的成功依赖于体外对T细胞的有效激活和扩增,传统方法使用固定在刚性表面或磁珠上的αCD3和αCD28分子(Beads3/28,图1a)。然而,这些方法依赖外源性IL-2且无法模拟T细胞与抗原呈递细胞(APC)细胞的自然相互作用(图1b)。
为克服这些不足,作者开发了石墨烯氧化物抗原呈递平台(GO-APP),通过柔性聚乙二醇(PEG)链将αCD3和αCD28修饰在石墨烯氧化物上(GO-APP3/28,图1c)。GO-APP3/28能够通过更好地模拟自然免疫突触,与T细胞形成更有效的接触,显著提升了T细胞的激活和扩增效率,并促使T细胞自发产生IL-2,解决了对外源IL-2的依赖这一留存已久的问题(图1d)。
此外,GO-APP3/28大幅提升了CAR-T细胞制造过程中CAR的转导效率,并使CAR-T细胞产量增加了5倍以上(图1e)。在患肿瘤的小鼠模型中,使用GO-APP3/28制备的CAR-T细胞更有效地抑制了肿瘤生长,并延长了小鼠的存活时间(图1f-h)。
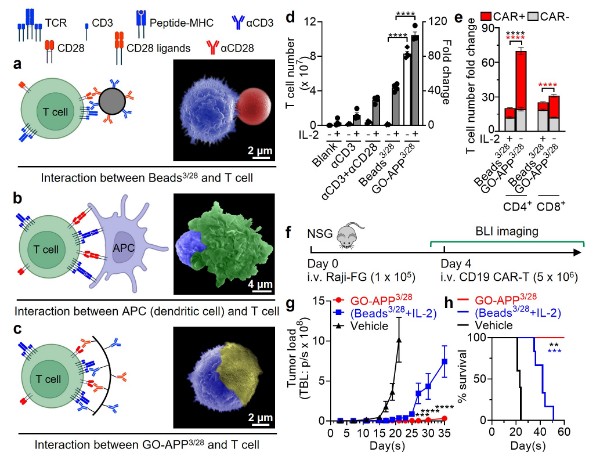
图1:石墨烯氧化物抗原呈递平台(GO-APP)的关键特性及效能。a-c,示意图和扫描电子显微镜(SEM)图像显示GO-APP3/28与T细胞的相互作用模拟了体内的免疫突触,增加了接触面积和抗原的可及性。d,GO-APP3/28刺激了T细胞的显著扩增,且不依赖外源IL-2。e,GO-APP3/28相比Beads3/28显著促进了CAR基因的转导。f-h,使用GO-APP3/28制备的CAR-T细胞治疗结果显示,肿瘤负荷减少(g),并延长了小鼠的生存时间(h)。
在RNA深度测序表征中,GO-APP3/28显著上调了与T细胞活化转录因子相关的基因,这些基因对T细胞信号传导和IL-2途径尤其重要(图2a-b)。单细胞RNA测序进一步揭示了GO-APP3/28激活的T细胞与Beads3/28激活的T细胞在基因表达上的显著差异(图2c)。通过Ingenuity Pathway Analysis(IPA)分析,GO-APP3/28激活的T细胞在TCR、CD3、IL-2和CD28信号通路中的基因表现出显著差异(图2d)。进一步分析显示,这些信号通路内的基因在GO-APP3/28激活的T细胞中,相较于Beads3/28激活的T细胞中明显增强(图2e-g)。与基因测序相映衬,在蛋白表征当中,GO-APP3/28刺激下的一些相关蛋白在表达和磷酸化水平上都有明显提升(图2h),这些相关蛋白涉及TCR、CD28所调节的通路以及IL-2信号通路中的关键转录因子。GO-APP3/28激活T细胞的作用机制如图所示(图2i)。
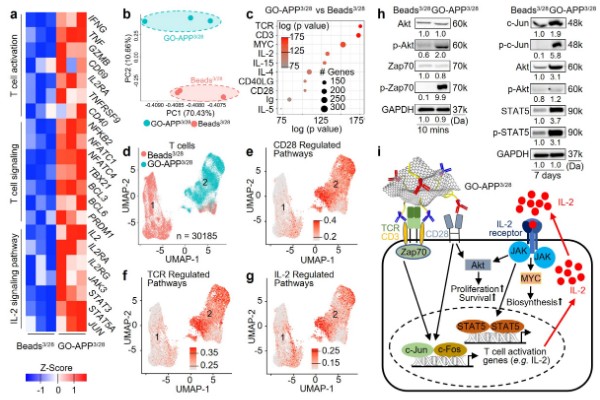
图2:GO-APP3/28刺激T细胞激活的机制研究。a-b,深度RNA测序:a,热图显示与T细胞激活、T细胞信号传导及IL-2信号通路相关基因的表达。b,基于全局基因表达的主成分分析。c-g,单细胞RNA测序:c,Ingenuity Pathway Analysis(IPA)揭示了前10个显著差异调控的信号通路,包括TCR(刺激)、CD3(刺激)、IL-2(促生存细胞因子)和CD28(共刺激)。d,UMAP图显示激活的T细胞形成了两个主要细胞簇。e-g,UMAP图显示TCR(e)、CD28(f)和IL-2(g)信号通路的基因表达,GO-APP3/28组相比Beads3/28组显著增强。h,Western blot显示TCR和IL-2信号通路分子在GO-APP3/28和Beads3/28激活的T细胞中的蛋白表达水平。i,示意图展示了GO-APP3/28通过TCR/CD3、CD28及IL-2信号网络促进T细胞激活的机制。
这些结果表明,GO-APP在设计上具备灵活性、在制备工艺上具备可靠性,而且在应用上具备广泛性。通过更精准地仿生细胞间的自然相互作用,这一新平台为探索和调控细胞膜上的信号蛋白提供了全新的方法和应用图景。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41565-024-01781-4