近日,中国科学院广州生物医药与健康研究院研究员王涛课题组和研究员王杰课题组合作,研究揭示了甲基转移样蛋白-1和WD重复结构域4(METTL1/WDR4)介导转运RNA(tRNA)的N7-甲基鸟苷(m7G)修饰对于维持衰老过程中蛋白质组稳态的重要作用,研究结果阐明了tRNA修饰对于衰老的调控作用。相关成果发表于《自然-通讯》(Nature Communications)。
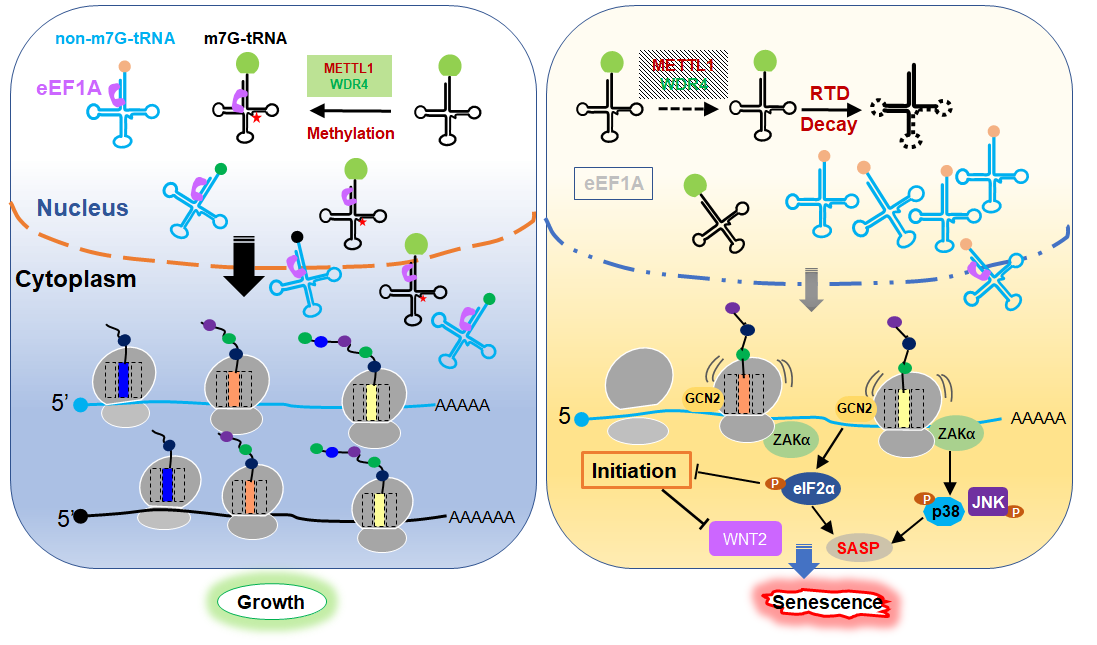
揭示了METTL1介导的tRNA修饰调控衰老的作用模式。研究团队供图
蛋白稳态失衡是衰老的一个重要特征,表现为蛋白质非正常折叠和异常聚集。衰老过程中多个因素共同作用导致蛋白稳态失衡:一方面,由于衰老而导致蛋白发生翻译异常包括错误氨基酸掺入、异常折叠和不完整蛋白随着衰老进程逐渐积累;另一方面,细胞的大分子自噬体系(溶酶体,蛋白酶体和分子伴侣)水平或功能降低导致异常蛋白质不能及时清除而积累,这两方面的因素共同作用引起细胞蛋白质组发生改变从而诱导衰老的发生。增强自噬的策略例如抑制哺乳动物雷帕霉素靶蛋白C1(mTORC1)活性,节食和运动均能够明显延缓模式动物的寿命。然而,衰老过程中为何会发生蛋白质翻译异常的原因仍然不清楚。
研究团队发现METTL1/WDR4不仅在三种衰老细胞模型而且在衰老的小鼠肝肾等组织中表达水平下调。FlucDM-GFP报告蛋白分析和衰老相关分析结果表明,敲降或敲除METTL1增加非正常折叠蛋白的聚集,加速细胞衰老;维持METTL1的表达则减少蛋白的聚集,延缓衰老进程。全身性可诱导敲除Mettl1显著加速小鼠衰老进程,其寿命只有6个月;过表达Mettl1可以明显促进顺铂-阿霉素诱导的肝肾损伤的修复。
机制研究表明,衰老伴随的RNA尤其是tRNA的m7G修饰水平降低导致一部分tRNA进入RTD途径加速降解从而引起tRNA的供给不足,导致核糖体长时间停滞于mRNA对应的密码子位置,激活了整合应急反应和核糖体毒性应急反应,前者通过磷酸化eIF2α抑制了细胞全局蛋白质合成的起始,后者通过磷酸化p38上调衰老相关炎症因子(SASP)分泌;另一方面,细胞周期蛋白和Wnt信号通路的蛋白质在翻译水平也被抑制。两方面的因素共同作用促进衰老的发生。该研究还验证了转录因子sp1对于Mettl1和Wdr4的转录调控作用。衰老进程中sp1显著降低,可能是m7G修饰复合物下调的一个重要调控因素。
先前研究揭示了METTL1/WDR4介导的RNA-m7G修饰参与干细胞分化、神经发育以及癌症的发展,该研究不仅揭示了m7G修饰调控衰老进程这一新的生理功能,而且阐明了引起衰老相关的蛋白稳态失衡的一条新的上游信号途径,这项结果为健康衰老的干预策略提供新的可能途径。(来源:中国科学报 朱汉斌)
相关论文信息:https://doi.org/10.1038/s41467-024-49796-8