2024年3月18日,华中科技大学
与技术学院李一伟教授和刘笔锋教授团队在Nature Chemistry期刊发表了题为“High-Throughput and Proteome-wide Discovery of Endogenous Biomolecular Condensates”的研究文章。同时,Nature Chemistry在线发表题为“Identifying Phase Separating Biomolecular Condensates in Cells”的Research briefing(研究简报),对该研究成果进行了宣传报道和积极评价。
该成果报道了一种高通量、无偏性的内源性相分离蛋白质鉴定新策略,通过对不同寡聚状态的蛋白质进行分类,实现了对细胞体积压缩和特定生物学过程中相分离蛋白质的鉴定。论文通讯作者是李一伟教授和刘笔锋教授,论文共同第一作者是李鹏杰和陈鹏副教授。
相分离是是一种近似于油水分离,从单一均匀混合物产生两个不同的相的过程。这种过程也同时发生在生命系统的细胞内。生命通过细胞内的相分离过程在时间和空间上有序调控多种生物事件,如信号转导、基因表达等。研究表明,细胞内的无膜细胞器,生物分子凝聚体,通过相分离过程逐步形成。异常的相分离过程可导致病理凝聚体的形成,这与肿瘤进展和神经退行性疾病有关。因此,相分离蛋白质的鉴定对于研究基本生命过程、寻找疾病治疗药物新靶点具有重要意义。尽管已经有数百种相分离蛋白质被报道、数千种相分离蛋白质被预测,但是现有的成果大量依赖于体外纯化蛋白和过表达体系。甚至有计算表明,人类蛋白质组的40%都是相分离蛋白质;也有理论认为,任何支持多价(位点>=3)的蛋白质均可以发生相分离。事实上,由于相分离行为广泛存在于不同类型的蛋白质中,且极易受到细胞内微环境的影响,内源性表达的蛋白质,在何种细胞内、何种微环境下、何种刺激下会发生相分离才是生物学的关键问题。然而,时至今日,细胞内源性的相分离蛋白质,几乎没有一个可行的方案实现组学水平的高通量鉴定,更缺乏有效手段用来鉴定生物过程响应的相分离蛋白质。
华中科技大学
与技术学院李一伟教授和刘笔锋教授团队聚焦蛋白质相分离的本质行为,由于相分离过程中存在蛋白质分子间大量的可逆物理性弱相互作用,蛋白质的相分离行为广谱地受到分子浓度、分子拥挤程度的物理调节。基于此,该团队创造性地利用细胞体积挤压,促使细胞内水分外流,造成细胞内蛋白质浓度的升高和分子拥挤程度增加。细胞内正在相分离的蛋白质,或者在相分离条件边缘的蛋白质,感受到物理调控因子的影响,也将必然改变其相分离程度。为了高效捕获到相分离程度发生微弱变化的蛋白质,项目团队结合蔗糖密度梯度离心技术和定量质谱技术,将在细胞体积挤压(1分钟)前后发生寡聚程度变化的蛋白质进行组学水平的高通量鉴定,所鉴定出的蛋白质即为候选相分离蛋白质。通过该方法鉴定了1454种在内源表达条件下会发生相分离的蛋白质,其中包括现有已知11种无膜细胞器的932种已知相分离蛋白质,以及522种未报道的相分离蛋白质。由于采用物理体积挤压的方法调控细胞,该研究发现了1215种力学响应的内源性相分离蛋白质。
更重要的,该方法可以用于鉴定生物信号转导过程中,或其他生物学过程中发生相分离的蛋白质。以TGF-β信号通路为例,该方法可以有效区分信号通路传导过程中的相分离蛋白质(TGF-β刺激40分钟内,75种响应相分离蛋白)和长程目标基因表达乃至细胞命运转变过程中的相分离蛋白质(TGF-β刺激2天,509种响应相分离蛋白)。其无偏性、高通量、灵敏性为该技术在生物学、生物医学领域的广泛应用奠定基础。该研究的免疫荧光染色、蛋白质体内过表达、免疫印迹等结果均支持该方法鉴定相分离蛋白质的准确性。
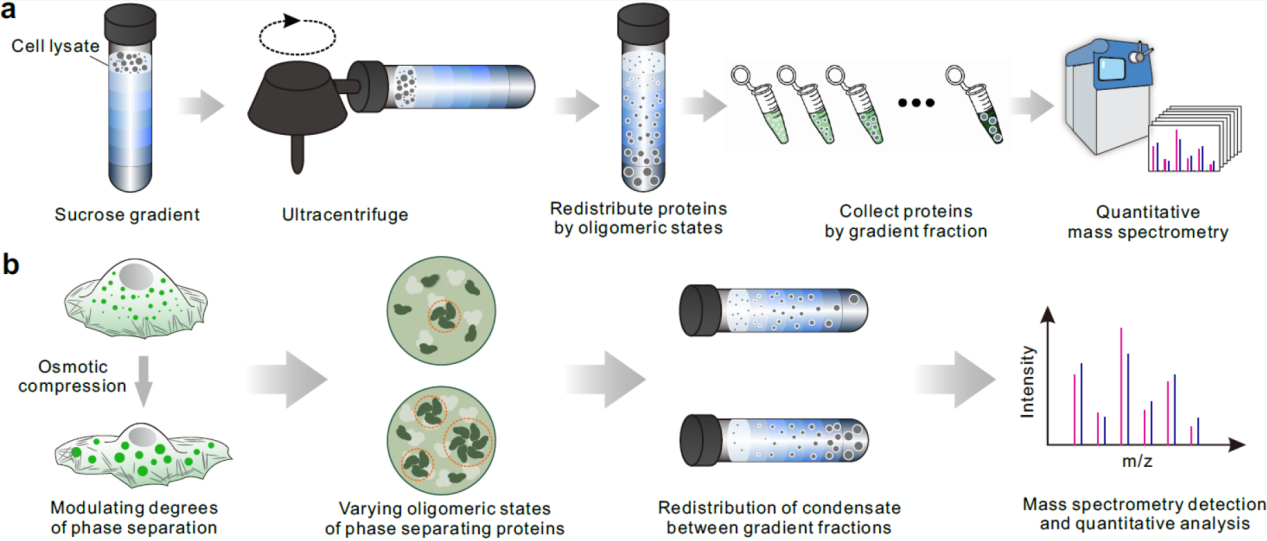
图1:内源性相分离蛋白质的鉴定示意图。
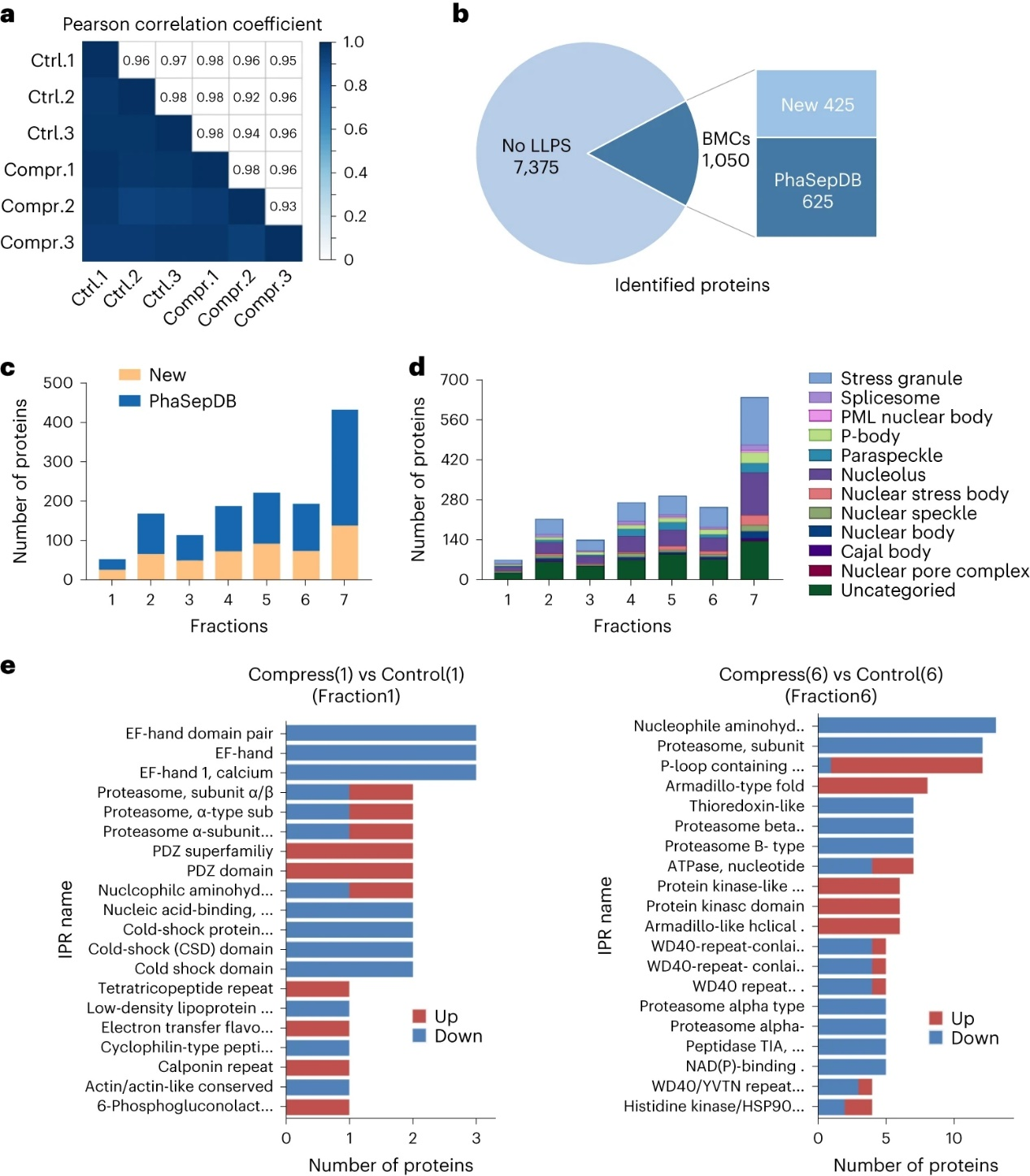
图2:高通量鉴定相分离蛋白质。
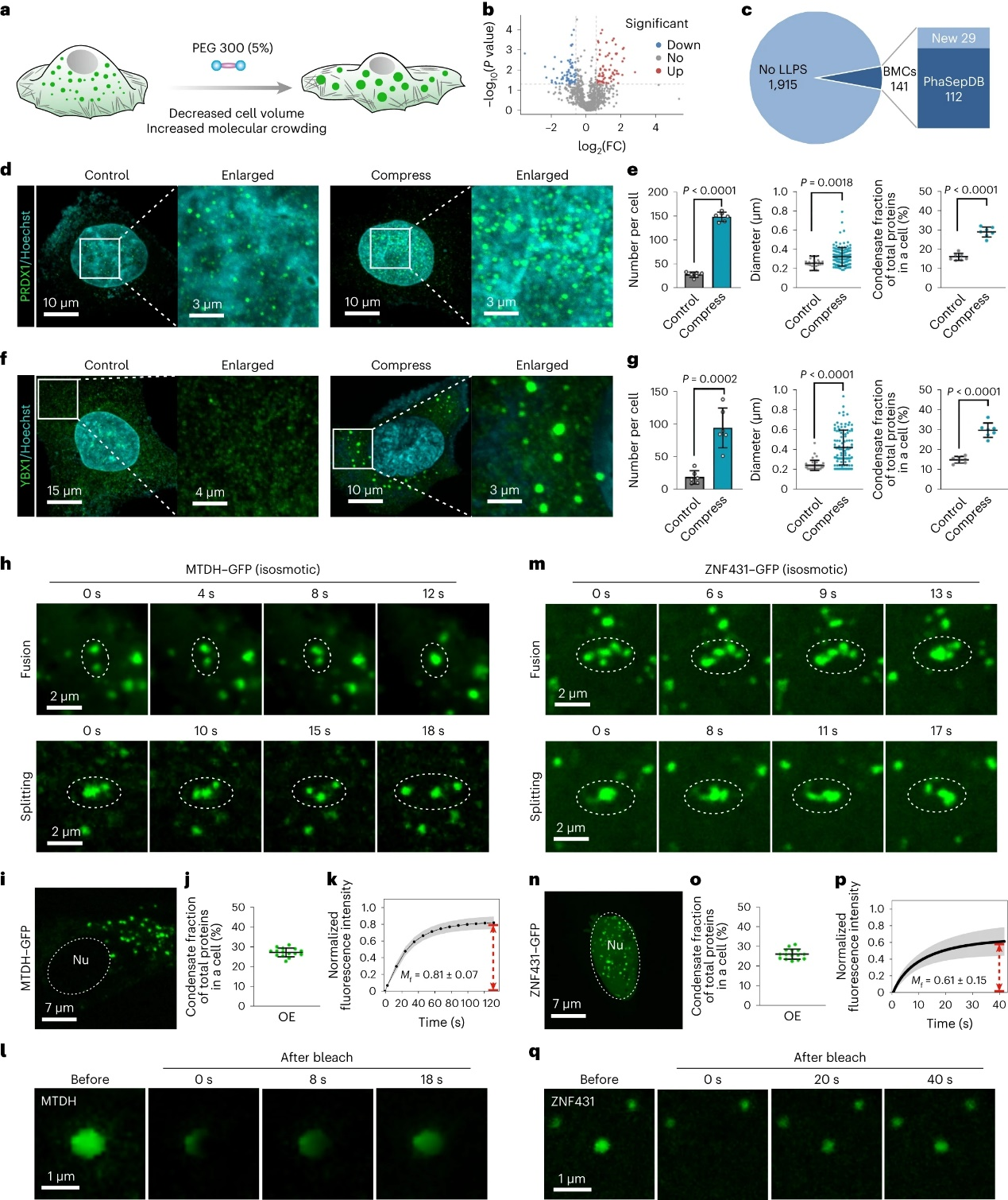
图3:响应细胞体积压缩相分离蛋白质的验证。
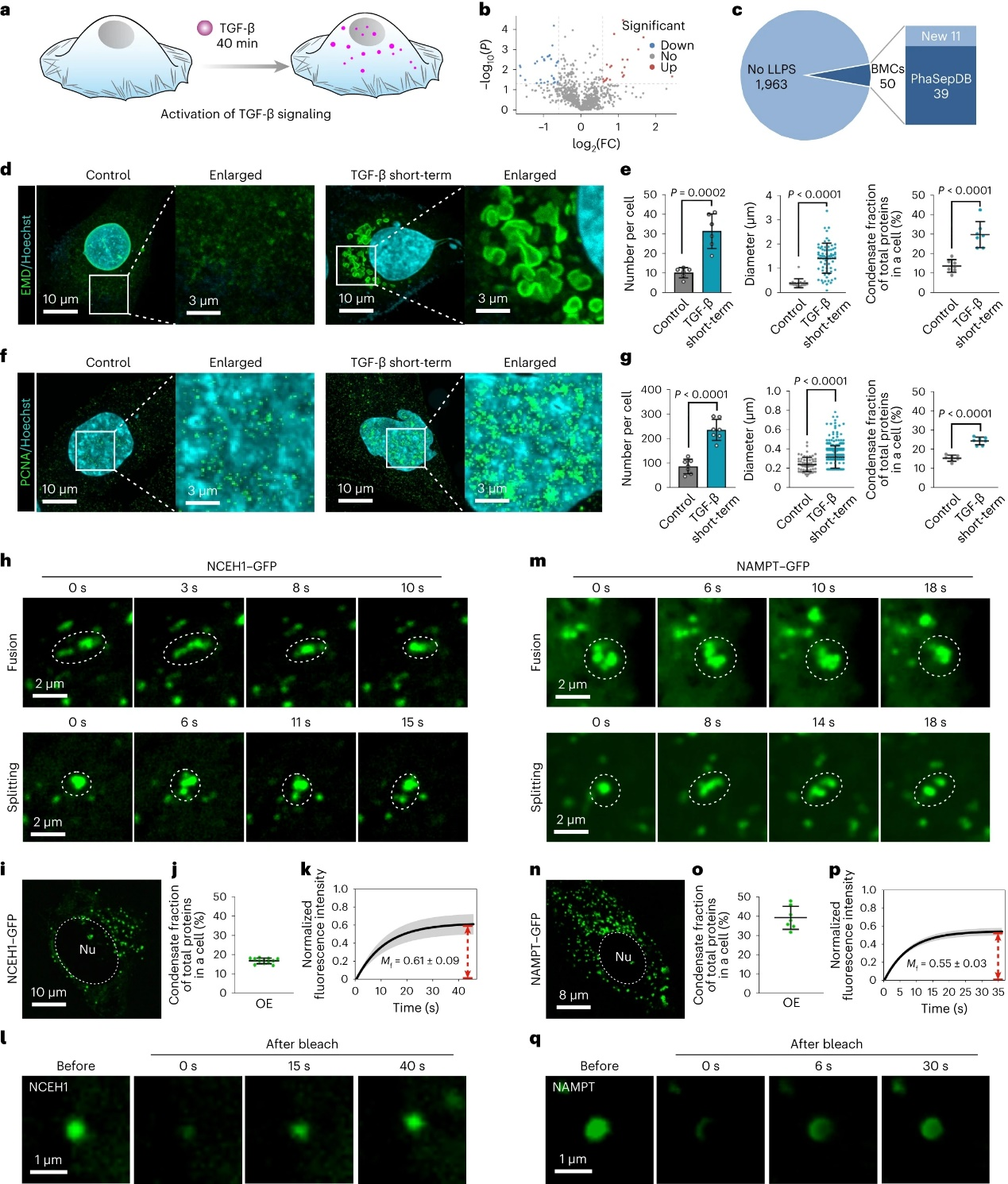
图4:响应TGF-β短时刺激凝聚体蛋白质的鉴定。
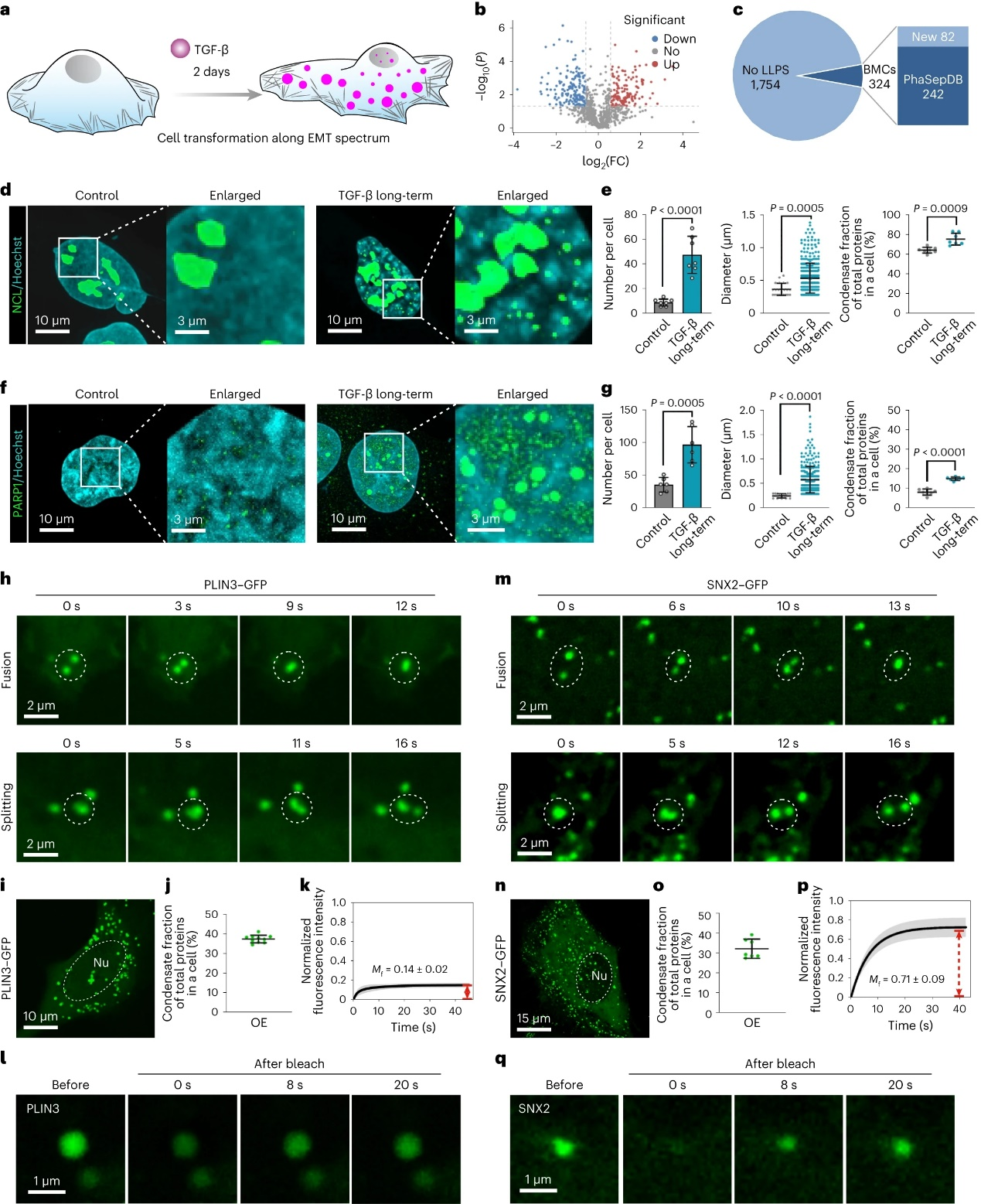
图5:响应TGF-β长时刺激凝聚体蛋白质的鉴定。
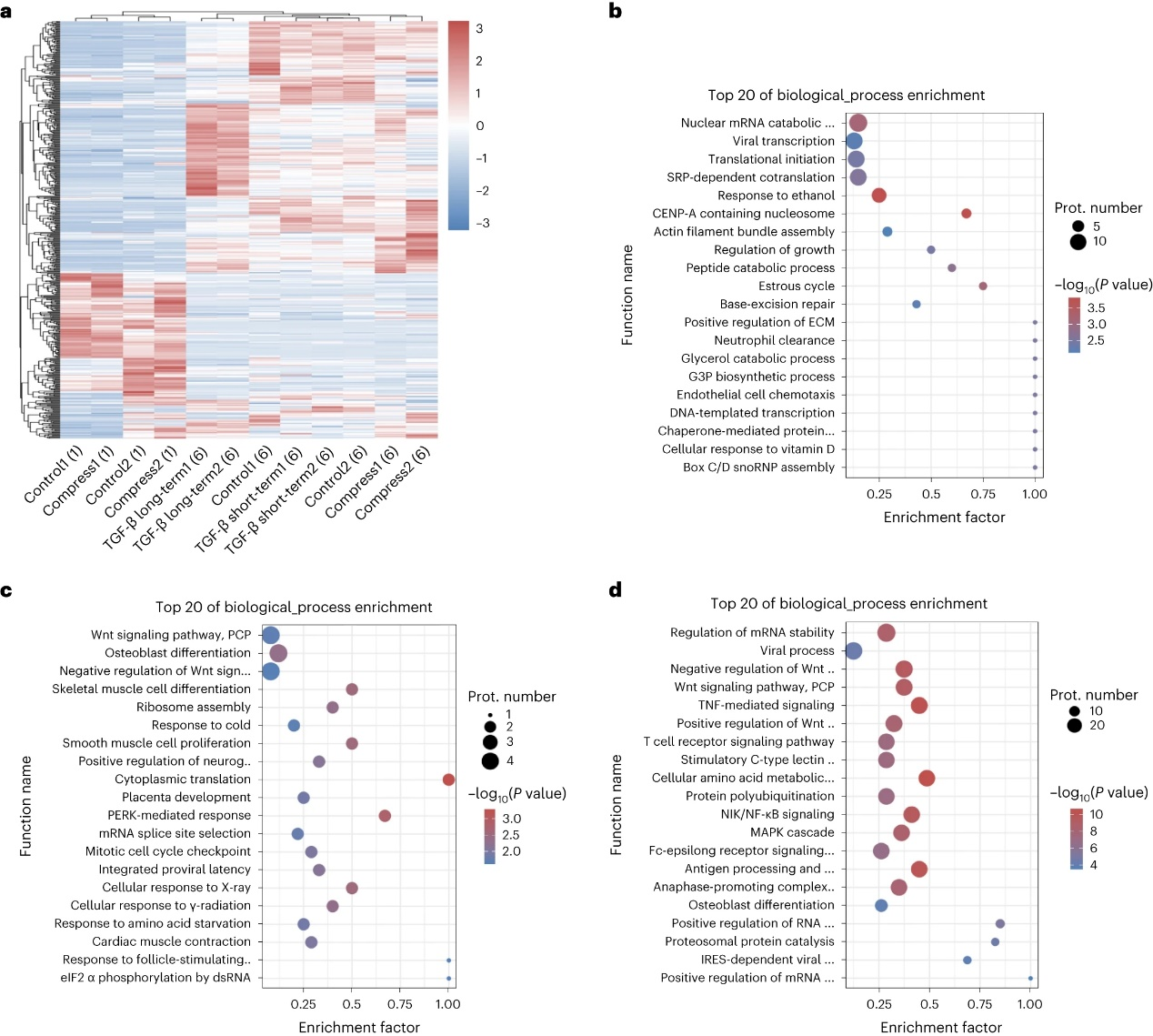
图6:内源性相分离蛋白质的组学范围分析。
这项研究整合了生物力学、生物物理学、生物医学设备开发、分析化学等多学科研究手段,快速扩展现有内源性相分离数据集,为内源性相分离蛋白质的鉴定、新型细胞器的发现及癌症等疾病的治疗靶点寻找提供了新的方法和思路。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-024-01485-1