|
|
|
|
|
利用CD8+ T细胞的无标记三维成像作为脓毒症的生物标志 |
|
|
导读
近日,来自韩国延世大学医学院的Yu Rang Park团队,开发了一种深度学习模型,利用CD8+ T细胞的内部形态来预测脓毒症的诊断和预后,对脓毒症的早期诊断和临床治疗具有重要意义。
研究背景
脓毒症(sepsis)是由于宿主对感染的反应失调而引起的危及生命的器官功能障碍。 脓毒症死亡率高,且缺乏特异性治疗,原因之一是脓毒症的免疫反应很复杂,并且在患者之间存在差异。对脓毒症的医疗干预措施哪怕延迟1小时也会导致死亡率增加,因此,早期诊断并迅速采取医疗操作至关重要。
许多特定的脓毒症生物标志物(biomarkers)可以用于提高诊断准确性,促进器官功能障碍的早期识别,协助风险分层,并监测个体的免疫反应。理想的生物标志物应能及时提供可靠的结果,可以进行重复测量,并准确反映患者的实时状态,确保病情的任何变化立即反映在生物标志物读数中,从而使治疗人员能够及时进行干预。然而,常用的生物标志物,如 C 反应蛋白 (CRP) 和降钙素原 (PCT) 都存在诸如反应延迟的缺陷。这种缺陷是由于免疫细胞分泌的细胞因子进行转录所需的时间,以及随后的翻译和蛋白质合成而产生的。研究人员们开发了一系列新的生物标志物和新技术,试图尽可能地减少时间延迟,然而这些方法都仍然表现出固有的时间滞后性,这也是分泌分子的常见缺点。
因此,如果能开发出迅速及时反应的生物标志物,以及对应的分析方法,无疑对于脓毒症的诊断和治疗具有极其重要的意义。
创新研究
在本研究中,研究成员基于全息成像和深度学习技术,探究了用免疫细胞结构作为脓毒症生物标志物的潜力。传统的染色和固定方法可能会改变细胞的天然状态,抑制动态细胞研究,并且非常耗时。全息摄影成像通过提供活细胞的无标记三维 (3D) 图像,能够实现对细胞的非破坏性实时研究,从而克服这些缺点。这项先进技术能够对折射率 (refractive index,RI)进行测量,这项指标与细胞生化和生物物理特性相关。同时,深度学习技术的发展简化了特征工程的过程,提高了整体分析准确性(图一)。
在这项研究中,研究人员采用无标记3D成像来分析免疫细胞结构从健康状态,到脓毒症诊断,以及整个脓毒症恢复期间的变化。通过比较健康对照组和脓毒症患者在不同恢复阶段的数据,研究人员发现了 CD8+ T 细胞的体积和干质量等形态特征在不同阶段中的显着变化(图二)。此外,研究人员还研究了细胞内的空间分布,揭示了与脓毒症相关的细胞结构的差异(图三)。为了处理来自这些 3D 细胞结构的大量数据,研究人员利用了深度学习模型,该模型在脓毒症诊断和预后预测方面表现出了良好的性能(图四)。本研究还探讨了细胞形态与脓毒症临床结果之间的相关性,进一步加深了人们对这种关系的理解。最后,本研究使用可解释的算法验证了研究所使用的深度学习模型,这表明本研究提出的方法可以有效地集成到临床环境中(图五)。
本研究开发了三维无标记 CD8+ T 细胞形态作为脓毒症有前途的生物标志物的潜力。这种方法便捷快速,仅需要少量的血液样本,并能为脓毒症的早期诊断和预后提供有价值的信息,对脓毒症的临床诊断与治疗具有极其重要的意义。
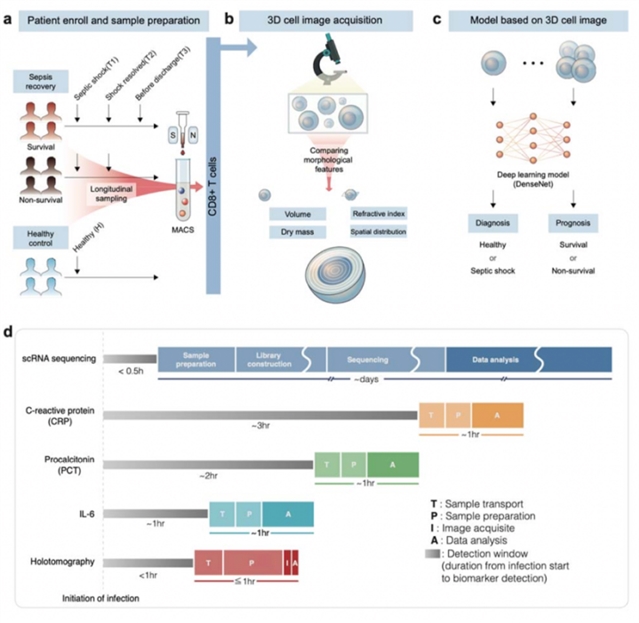
图一:研究工作流程示意图。(a)这项研究包括脓毒症康复和健康控制。脓毒症恢复队列分为存活组和非存活组。在脓毒症恢复队列中采集了三次血液样本,在健康对照队列中采集了一次血液样本。使用磁性细胞分离器 (Magnetic Cell Separator , MACS) 从血液中提取 CD8+ T细胞。(b)使用全息摄影术获取 3D 细胞图像。获得并比较 3D细胞和2D切片图像的形态特征。将细胞内的空间分布与壳结构的空间分布进行比较。(c)基于内部细胞结构开发并验证了用于预测脓毒症诊断和预后的深度学习模型。PBMCs:外周血单个核细胞;ICU: 重症监护病房。(d)该示意图将当前使用的生物标志物(包括 C 反应蛋白 (CRP)、降钙素原 (PCT) 和 IL-6)的消耗时间与本研究提出的方法(holotomography,全息摄影)进行了比较。此外,还比较了scRNA(single cell RNA, scRNA)测序方法。该图突出显示了样品运输 (T)、样品制备 (P)、图像采集 (I) 和数据分析 (A) 的步骤,强调了从感染开始到检测到生物标志物的持续时间(检测窗口)。它还强调了每个步骤所花费的时间,展示了本研究提出的方法的效率。
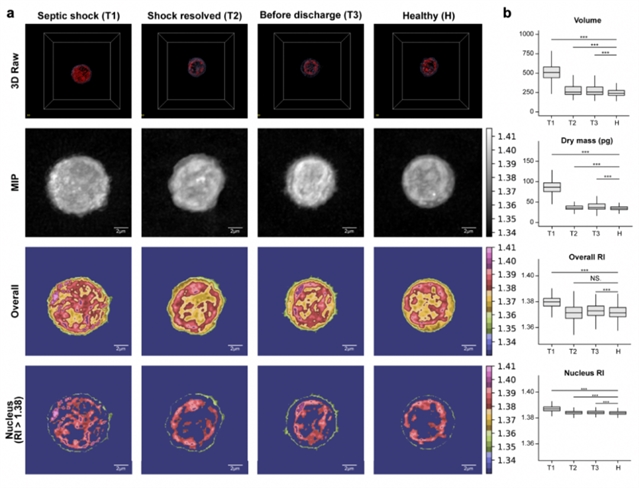
图二:感染性休克恢复状态和健康对照组中细胞的形态学和形态特征概述。(a)绘制各阶段状态下的原始3D图像、中点光学切片图像、整体成分着色图像、细胞核成分着色的细胞形态图像;(b)为每个特征绘制了箱线图和显着性:体积、干质量、总体和细胞核RI分布。MIP:最大强度投影;RI:折射率。
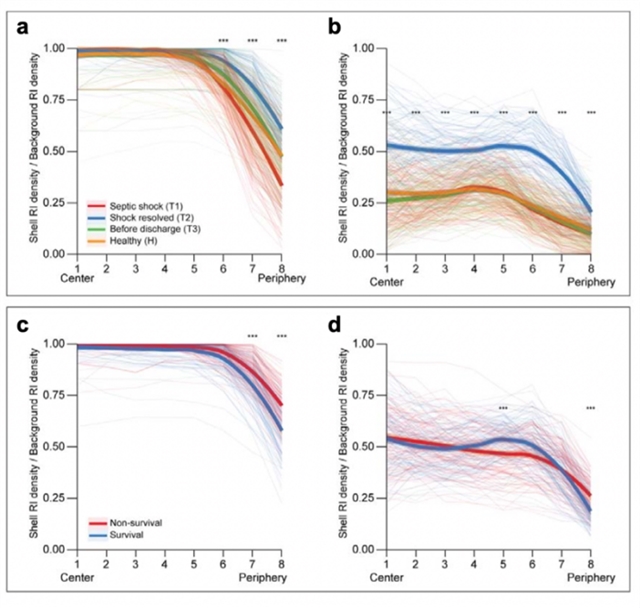
图三:纵向脓毒症恢复和健康控制中每个时间点细胞内的空间分布。脓毒症恢复第一时间点(T1)存活组和非存活组细胞内的空间分布与壳结构密度。二维截面图像被分为八个椭圆形区域,其中最靠近中心的区域称为Shell 1,距离中心最远的区域称为Shell 8。壳密度定义为高于目标RI值的像素数量相对于该壳层中的像素总数的比值。(a)脓毒症恢复和健康组中每个时间点的总体 RI 的壳密度。(b) 脓毒症恢复和健康组中各时间点核成分 RI 的壳密度分布。(c)T1 时刻存活组和非存活组的总体 RI 的壳密度。(d) T1 时幸存者和非幸存者中核成分 RI 的壳密度。*** 表示调整后的 p 值 <0.001。RI,相对强度;T1:时间点1;T2:时间点2;T3:败血症恢复的时间点3。
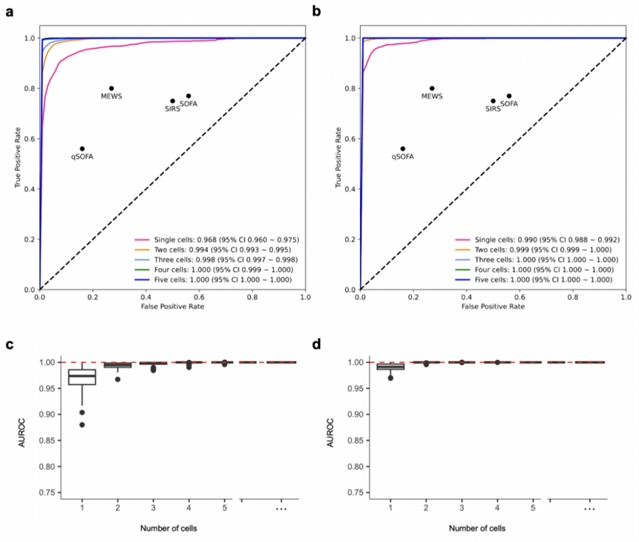
图四:该方法在预测诊断和预后模型中使用一到五个细胞的受试者工作特征(receiver operating characteristic,ROC)曲线。模型预测的(a)诊断的ROC曲线,对感染性休克状态和健康对照进行了分类,以及预测的(b)预后的ROC曲线,分为存活组和非存活组,包括了AUROC 和相关的 95% 置信区间。两幅图中的黑点描绘了用于预测脓毒症诊断和预后的每个临床指标的精确度和召回率。用于预测(c)诊断和(d).随机取样细胞时的预后的ROC的箱线图。AUROC:接受者操作特征曲线下的面积;SIRS:全身炎症反应综合征;SOFA:序贯器官衰竭评估;qSOFA:快速序贯器官衰竭评估;MEWS:修正早期预警评分;CI:置信区间。
该文章发表在国际顶尖学术期刊《Light: Science & Applications》,题为“Three-dimensional label-free morphology of CD8+ T cells as a sepsis biomarker”, MinDong Sung为论文的第一作者。(来源:LightScienceApplications微信公众号)
相关论文信息:https://www.nature.com/articles/s41377-023-01309-w
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。