导 读
近日,日本东京大学物理系和光子科学与技术研究所Takuro Ideguchi团队开发了一种显著改进的宽视场中红外(MIP)定量相位显微镜,其信噪比比以前的MIP成像技术高两个数量级,并展示了超过视频速率的活细胞成像。团队首先通过数值模拟光热效应后的热传导推导出最佳的系统设计。然后,利用自制的纳秒微波光学参量振荡器和高全阱容量的图像传感器开发了所设计的系统。开发的高速、高空间分辨率的MIR显微镜具有成为 (特别是活细胞分析)新工具的巨大潜力。
研究背景
拉曼散射和中红外 (MIR) 吸收成像等振动成像在 领域的应用引起了人们的广泛关注,例如在单细胞生物学领域,因为其无需标记可以解决与荧光成像相关的问题,例如由于细胞毒性导致的细胞损伤或死亡、光漂白导致的连续和定量测量的困难、以及标记的细胞内生物分子的不良功能修饰。大多数单细胞振动成像技术都利用拉曼散射,最先进的相干拉曼散射 (CRS) 显微镜已经实现了视频速率下的高速成像。这些高速 CRS 成像系统在振动成像领域产生了重大影响,并引发了相关研究的急剧扩展,包括仪器开发和生物应用,特别是活细胞分析。由于中红外吸收过程的大吸收截面(比拉曼散射高约 108倍)和对生物分子的低光损伤,中红外吸收成像在 中具有巨大的潜力。相比之下,CRS 成像利用紧密聚焦的超短激光脉冲触发非线性光学效应来执行敏感测量,导致不需要的多光子电子跃迁,从而对活细胞产生有害影响。MIR 吸收避免了这个问题,因为它是一个低光子能量的单光子线性吸收过程。此外,使用中红外光成像有可能获得拉曼光谱迄今未揭示的信息。MIR 光谱提供了关于主要存在于细胞中的生物分子的丰富信息,例如蛋白质和水。
MIR光热成像是最近几年研究的一种新兴技术,其可以解决以上问题并能够进行单细胞MIR吸收成像。在这种技术中,MIR分子吸收引起样品中的局部加热,并通过光学参数(如相位)的变化来检测由此产生的折射率变化、反射率或散射强度可见的探测光。因此,人们可以以亚微米分辨率获得关于MIR吸收的空间分布的信息。此外,只要MIR光到达细胞,由于生物样品中可见光的透明性,就有可能捕获细胞内折射率的变化,即使MIR光随后被细胞后面的水吸收。
然而,当前的MIP成像系统的性能,尤其是帧速率,还没有达到现有CRS成像系统的水平。
创新研究
在这项工作中,团队开发了一种MIP成像系统,该系统具有高强度MIR纳秒光学参量振荡器和高灵敏度定量相位成像,使用满阱容量 CMOS 图像传感器,首次实现了超越视频速率的活细胞MIP成像。
首先,团队进行热传导模拟,以得出用于宽视场中红外成像的 MIR 、可见光的最佳脉冲持续时间和重复率:分别小于10 ns 和~1 kHz,如图1。然后,团队开发了一种波长可调谐的 MIR 纳秒光学参量振荡器,它具有周期性极化的铌酸锂(PPLN)晶体。接下来,团队采用高阱容量 CMOS 图像传感器进行定量相位测量,捕获的光子比传统图像传感器多100倍。
显微镜的高信噪比和高速能力预计将有利于细胞内动力学的视频速率观察,以及在不到 1 秒的时间内采集超过数百 cm-1的高速宽带MIR光谱图像。
最后,团队研究了当前和改进系统可以实现的潜在应用。当前系统的可观测带宽在2800-3400 cm-1范围内,可实现CH、酰胺A和B波段以及OH波段的光谱成像。例如,可以通过 H2O 和 D2O 的差分光谱可视化水的细胞内动力学(如图2所示),通过观察CH2信号的时间变化来评估细胞衰老,以及可视化特定的碳水化合物。

图1 通过热传导模拟得出MIR和可见光的最佳脉冲持续时间和重复率。
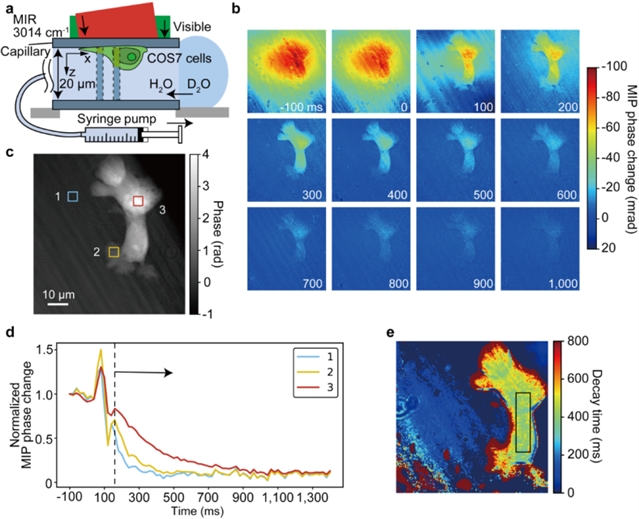
图2 通过水通道蛋白对活COS7细胞中的H2O/D2O交换进行视频速率MIP成像。
该文章近日发表在国际顶尖学术期刊《Light: Science & Applications》,题为“Label-free mid-infrared photothermal live-cell imaging beyond video rate”,Genki Ishigane和Keiichiro Toda为论文的共同第一作者,Takuro Ideguchi教授为论文的通讯作者。(来源:LightScienceApplications微信公众号)
相关论文信息:https://doi.org/10.1038/s41377-023-01214-2
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。