|
|
| 近红外第二窗口新型稀土荧光探针用于活体多重荧光成像 |
|
荧光成像技术具有非侵入性、即时反馈、高灵敏度以及高空间分辨率的特点,这使得其在生物医学成像领域具有不可替代的优势。而借助于多种荧光探针同时标记多个待测物的多重荧光成像技术的出现为研究复杂的生理-病理机制提供了有效的研究方法。然而在实际应用中,该技术仍然存在成像深度浅、成像分辨率和信噪比低以及无法多通道动态实时成像等诸多的挑战,其中缺乏高效的近红外荧光探针以及能够进行实时多重荧光成像的仪器是阻碍这一技术进一步发展的至关重要的因素。因此,能否开发系列近红外区荧光增强的探针以及相匹配的多通道实时成像的装置来解决上述难题呢?
北京时间2023年6月22日,Nature Nanotechnology期刊在线发表了复旦大学化学系教授张凡团队的科研成果《近红外二区荧光增强的纳米晶体用于实时动态的活体多重荧光成像》(“Fluorescence amplified nanocrystals in the second near-infrared window for in vivo real-time dynamic multiplexed imaging”),为以上难题的攻克提供了全新的思路。这也是复旦大学通过交叉学科研究取得的又一重大成果。
复旦大学化学系2019级博士生杨一唯、陈莹为第一作者;复旦大学化学系张凡教授、凡勇青年研究员为通讯作者。
▌技术进步:近红外荧光成像逐步应用于实时动态的活体多重成像
荧光是自然界中的一种光致发光现象。由于其灵敏度高、即时反馈、操作便捷等特点,使得荧光成像在临床医学诊断、基础生物学探索及解剖学结构研究中有着巨大的优势。而借助于多种荧光探针同时标记多个待测物的多重荧光成像技术,研究人员能够对多个待测物的活动进行实时动态的追踪,有利于揭示生物体复杂的生理-病理机制。
目前该成像技术主要集中在可见光区(400-650 nm)及近红外一区(650-900 nm),由于存在生物组织对该窗口光的吸收和散射强等问题,使得在这个窗口内的光学穿透深度和成像分辨率都不理想。为了解决这个问题,研究人员通常会采用手术开辟视窗的方法来暴露所研究的部位,从而期望能够更精准理解活体原位微环境的生理机制,但视窗不可避免地对正常生理环境造成破坏,为检测结果带来不可控的干扰。因此如何在深层组织中实现多重荧光成像是阻碍这一技术进一步发展的至关重要的问题。
近年来的研究表明,近红外第二窗口的光(1000-1700 nm)在皮肤、脂肪和骨骼等生物组织中传播时受到比可见光和近红外一区光更小的散射作用和生物体自发荧光背景噪声。尤其对于波长位于1500-1700 nm的子成像窗口,其受到的组织散射进一步降低,生物体自发荧光背景噪声几乎消失,因此被认为是一个实现活体深组织高分辨和高信噪比成像极具发展潜力的生物“透明”窗口。然而位于该“透明”成像窗口的动态多重活体荧光成像研究仍旧不理想,一方面是受限于该成像窗口可用的荧光探针,目前已报道的只有基于Er3+的稀土荧光探针以及半峰宽度大的半导体量子点;另一方面是缺乏相应能够进行实时多重荧光成像的装置和技术,因此无法在活体实现实时动态的多重荧光成像。
▌研究突破:开发荧光增强的近红外稀土荧光探针及双通道荧光成像装置实现实时动态的多重活体荧光成像
针对以上难题,张凡团队开发了一系列立方晶相的稀土碱金属氟化物纳米荧光探针,并搭建了双通道荧光成像装置,在1500-1700 nm波段实现了活体实时动态的多重成像。传统的研究中,由于六方晶相的稀土碱金属氟化物(β-NaREF4)具有较小的声子能,从而导致更低的非辐射弛豫概率,通常被认为更加有利于提高发光效率,因此作为一种经典的稀土探针基质而广泛使用。而在张凡团队成员发现,相较于β-NaREF4基质,在立方晶相的碱金属氟化物(α-NaREF4)基质中,Tm3+掺杂的稀土荧光探针在1632 nm处中有近百倍的下转移发光增强。通过拉曼光谱、变温荧光及光子数测试证明α-NaREF4基质较高的声子能有效地促进Tm3+的电子从3H4能级通过非辐射跃迁的方式到达3F4能级,从而增强了3F4能级的电子布居,且立方相基质中激活剂离子间的交叉弛豫以及激活剂离子与敏化剂离子之间的能量传递过程也进一步导致了Tm3+在1632 nm处的下转移发光增强。基于此荧光增强机理,也实现了Er3+和Ho3+掺杂的近红外稀土荧光探针在1530 nm和1180 nm处不同程度的下转移发光增强。该Tm3+元素掺杂的新型近红外稀土荧光探针为近红外二区多重荧光成像提供了新的波长选择。
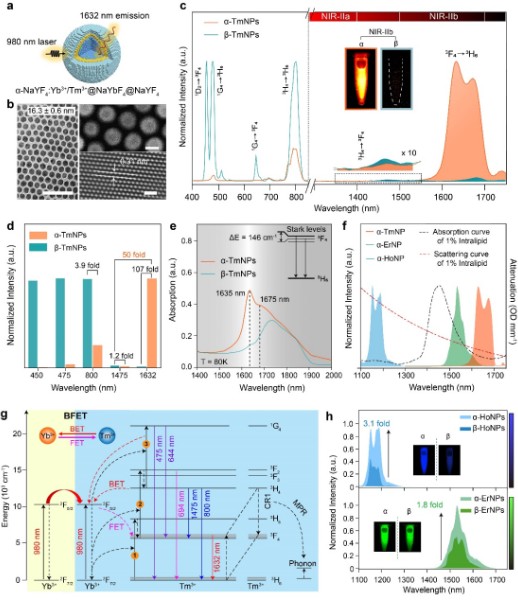
图1:(a-b) Tm3+掺杂的立方相纳米颗粒核壳结构示意图及电镜图;(c-d) Tm3+掺杂的立方相及六方晶相纳米颗粒发射光谱及不同波长处发光强度柱状图;(e) 低温吸收光谱;(f) 基于Tm3+、Er3+、Ho3+掺杂的立方相纳米颗粒发射光谱及脂肪乳剂的吸收、散射曲线;(g) Yb-Tm体系能量传递机理;(h)Er3+和Ho3+元素掺杂的立方相和六方相纳米颗粒的发射光谱及荧光成像图。
针对所开发的系列近红外第二窗口荧光增强的新型稀土荧光探针,张凡团队进一步开发了与之匹配的高时空同步的实时动态多重成像装置。与常规通过切换滤光片实现多通道成像的系统相比,该成像装置能够对两个不同通道的荧光信号进行实时同步收集,体外不同荧光探针同时修饰的不同微球运动模拟实验也验证了装置能够保证双通道高度同步的时空成像,为后续多种新型近红外稀土荧光探针用于活体实时动态多重荧光成像打下基础。
最后,张凡团队在生物组织精细结构水平上验证了该成像技术用于探索深组织生理活动机制的可行性。首先通过对不同近红外稀土荧光探针表面进行功能化修饰,实现了对活体小鼠脑部血管网络中各级血管的区分。团队随后使用激素刺激小鼠来模拟神经对血流的调控作用,利用该成像技术能够在不开辟颅窗的情况下实现对小鼠动脉血管的舒缩运动进行实时动态的监测,有望为血液动力学研究提供更加精准的信息。为进一步探索该成像技术用于活体深组织多重荧光成像的潜力,团队利用开发的新型近红外稀土荧光探针特异性地标记了小鼠的中性粒细胞,通过该成像技术实现了在单细胞水平上的免疫反应监测,能够对单个中性粒细胞在皮下炎症部位及脑损伤部位趋化性、外渗、激活等过程进行实时动态监测。相比于传统的成像方法,该近红外新型稀土荧光探针及双通道实时成像技术有效避免了开辟视窗造成组织损伤对观测结果带来的干扰,为在活体水平研究细胞免疫反应提供了新的思路。
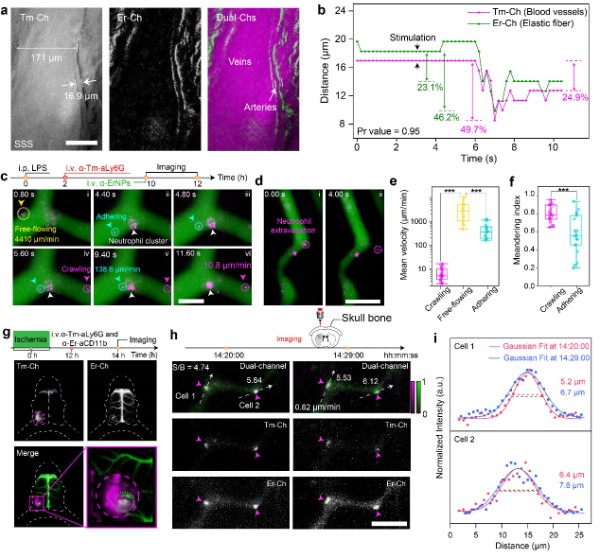
图2:(a-b) 基于新型近红外荧光探针构建的活体动态多重成像方案,实现了小鼠脑部血管舒缩运动的实时动态监测;(c-f) 基于新型近红外荧光探针构建的活体动态多重成像方案,实现了对中性粒细胞在皮下炎症部位趋化作用及外渗过程的实时动态监测和分析。(g-i) 基于新型近红外荧光探针构建的活体动态多重成像方案,实现了在脑卒中小鼠脑损伤部位激活态中性粒细胞免疫反应的实时动态成像。
目前,尽管该研究已经取得了较好的初步应用效果,未来还需要更进一步地提高探针的发光效率以及增加荧光发射通道,从而满足对活体内更高成像速度、更深组织成像以及更高通量多重检测应用的需求。此外,改善荧光探针的功能修饰特性,增强与前沿生物与成像技术的兼容性等问题仍然有待后续研究。但是这一科研成果所点亮的诸多可能,都将为化学与材料科学、生物医学光子学、 、生物医学工程和医疗诊断等领域拓宽研究视野。
研究工作得到了复旦大学化学系、聚合物工程国家重点实验室、上海市分子催化和功能材料重点实验室、国家重点研发项目、国家自然科学基金委员会、上海市科学技术委员会等机构与项目的大力支持。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41565-023-01422-2