复旦大学人类表型组研究院供图
8月6日,复旦大学人类表型组研究院研究员丁琛团队在Advanced Science发表最新研究成果。该团队聚焦转录因子研究十余年,在世界范围内首次实现大规模甲基化转录因子阅读器的鉴定及功能研究。最新研究提供了最全面的转录因子—被修饰DNA相互作用组,涵盖70%的转录因子。
值得一提的是,这些数据集将使该领域的其他研究人员能够深入挖掘不同层次的表观遗传调控机制。此外,该数据集将增强对DNA甲基化修饰驱动的表观遗传学在与发育和疾病相关的关键生物过程中触发的分子机制的理解。
复旦大学人类表型组研究院博士研究生白琳为论文第一作者,丁琛和中科院生物化学与细胞生物学研究所研究员杨雯隽为论文的通讯作者。
转录因子表达丰度极低
转录是将遗传信息由DNA复制到RNA的过程,是蛋白质生物合成的第一步,相当于对DNA进行“解码”和“翻译”的起始。转录因子(TF)是调控生物体转录过程的重要物质。
转录因子在几乎所有生物过程和基因表达模式中都发挥着关键作用。据统计,人类基因组中约有1500个转录因子编码基因。转录因子可特异性识别下游靶基因,并随后一起构建出转录或转录共调节子与DNA的复合体,从而在调控各种生物过程的激活或者抑制中发挥重要作用。然而,转录因子在细胞内的表达丰度极低,使得对转录因子及其形成的复合物的纯化及鉴定非常困难。
尽管 DNA 甲基化在各种生物过程和物种中都有过研究报道,但是对这些数据集的解释往往不能提供对DNA甲基化水平动态变化的机制性理解。建立DNA甲基化和表观遗传领域的生理结果之间的因果关系是
前沿领域的一个重要挑战。
丁琛介绍,从以有的研究结果来看,要理解DNA甲基化机制的第一步,就要识别出将甲基化信号转化为生物行为的DNA甲基化“阅读器”和“写入器”,即要确定与DNA甲基化动力学相关的蛋白质和DNA之间的相互作用,这对于破译通过甲基化方式开展的各类生物过程中的遗传“密码”至关重要。
然而,另一个难题又来了。“因为转录因子在生物体内先天丰度的不足,迄今为止对于转录因子阅读器的大规模研究仍无能为力。” 丁琛说。
拓展一项原创关键技术
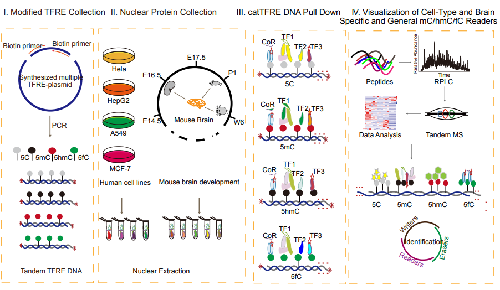
这一最新成果取得的基础,是由丁琛团队自主开发并于2013年首次发布的一项原创关键技术——转录因子串联结合元件序列(catTFRE)。该技术利用转录因子与序列特异性DNA元件结合的特点,首次设计合成串联各种转录因子的多拷贝双链DNA结合元件,并通过与预先制备好的核蛋白一起孵育,从而从核蛋白中分离纯化具有DNA结合活性的内源转录因子及其复合物。
“可以说,catTFRE是研究转录调控领域的一项关键核心技术,对开展生物医学前沿领域的创新研究具有重大价值。”丁琛说。
然而,catTFRE这一技术是否可能拓展到表观遗传修饰的研究中,以及是否可以通过改良该技术进行大规模的表观遗传修饰转录因子阅读器的大规模筛选,仍未知。
经过多年持续攻关,丁琛团队最终成功利用改良的modi-catTFRE技术进行了大规模的内源性甲基化、羟甲基化、甲酰基化转录因子阅读器的鉴定及功能研究,在表观遗传学领域取得了重要科研进展。
在本次研究中,研究人员首先通过PCR扩增技术,以catTFRE为模版,以不同修饰的胞嘧啶碱基为原料分别获得了5甲基胞嘧啶-TFRE序列(5mC-TFRE)、5羟甲基胞嘧啶-TFRE序列(5hmC-TFRE)和5甲酰基胞嘧啶-TFRE序列(5fC-TFRE),研究使用四种肿瘤细胞系和小鼠脑发育的五个时间点的核蛋白提取物,使用无标记定量质谱技术,共覆盖到约70%的转录因子,提供全景式蛋白质组学下的转录因子和被修饰DNA(TF-modified DNA)的结合模式。该研究同时还鉴定到多种特定修饰结合的转录共调解因子以及DNA结合蛋白等,并对5C、5mC、5hmC、5fC-modified特异偏好结合转录因子阅读器进行了功能富集分析。结果显示,无修饰5胞嘧啶DNA序列(5C-modified DAN)结合转录因子主要执行常规功能;5羟甲基胞嘧啶DNA序列和5甲酰基胞嘧啶DNA序列(5hmC&5fC-modified DNA)结合转录因子主要参与发育、分化等功能。
同时,该研究还全面解析24个转录因子家族和35个转录因子结构域与甲基化修饰DNA结合的偏好性。其中,SCAN结构域显著偏好结合5甲酰基胞嘧啶DNA序列(5fC-modified DNA),模拟蛋白结构解析同样证明该结论,进一步证明表观遗传驱动的特征生物学过程。
除此之外,研究人员还对小鼠大脑发育过程中转录因子特异甲基化修饰DNA结合模式的动力学进行了实证研究,揭示鼠脑发育过程的全景式转录因子—被修饰DNA结合模式,阐明不同转录因子修饰的DNA复合物在控制不同基因表达中的作用。转录因子—被修饰DNA相互作用组在不同发育阶段具有不同的结合偏好性,进一步证明大脑发育过程中动态表观遗传调控所起到的的关键作用。(来源:中国科学报 黄辛)
相关论文信息:https://doi.org/10.1002/advs.202101426
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。