2021年08月13日,《ACS Central Science》在线发表了北京大学与斯克里普斯研究所合作研究团队的最新研究成果,题为“Modulation of Siglec-7 Signaling Via In Situ-Created High-Affinity cis-Ligands”。
在本篇长文中,研究人员揭示了肿瘤细胞在被自然杀伤免疫细胞(NK)攻击时,可通过下调细胞膜上糖蛋白的回收速率,快速堆积新生成的唾液酸化聚糖配体,增强其与NK细胞表面免疫抑制性受体—Siglec-7作用,进而抑制NK杀伤活性。值得注意的是,癌细胞表面唾液酸化聚糖的动态升高,为干预其介导的免疫逃逸,提出了新的难度和挑战。
北京大学药学院的洪森炼研究员为该论文的第一作者,斯克里普斯研究所Peng Wu教授为通讯作者。
癌症乃万疾之王,给人类的健康生活和生产造成了巨大损失。癌细胞表面聚糖与免疫细胞膜上抑制性受体之间的相互作用,被认定为一类新的免疫关键点,打开了改善癌症防治效果的新视角。研究此类相互作用调控机体免疫活性的生物学机制、并开发化学分子工具外源阻断癌细胞聚糖所介导的免疫逃逸,成为了目前抗肿瘤研究的热点和难点领域之一。
NK细胞疗法是近年来发展迅速且生物安全性优于CAR-T细胞疗法的肿瘤免疫过继疗法之一。癌细胞表面高唾液酸化保护层,同样,也限制了NK细胞疗法对此类肿瘤的杀伤。研究团队通过活细胞表面糖基编辑技术,在过继的治疗性NK细胞表面原位生成Siglec-7的高亲和力糖配体,与其膜上免疫抑制性Siglec-7受体顺式相互作用。此类强的相互作用很难被肿瘤细胞表面天然的唾液酸化糖配体所交换下来。修饰低丰度的顺式高亲和力配体后,NK细胞能更好地杀伤高唾液酸修饰的癌细胞。该成果基于化学酶法编辑免疫细胞表面聚糖结构的技术,是继该研究团队先前工作(Angew. Chem. Int. Ed., 2020, 60, 3603-3610)之后,在化学功能化治疗细胞领域又一新突破。
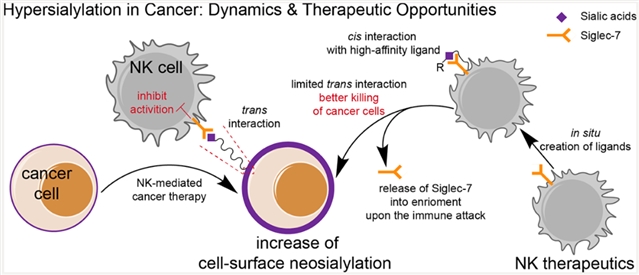
图1:NK细胞免疫攻击促进肿瘤细胞高唾液酸化;在NK治疗细胞表面原位生成Siglec-7高亲和力配体以释放此抑制性受体并增强NK细胞对肿瘤杀伤。
在这项研究中,研究人员还发现,免疫抑制性Siglec-7受体与高亲和力配体顺式作用后,会被释放进入环境中;研究人员猜测NK细胞起始免疫攻击后,增强的膜分泌能力可能主要介导了该释放过程,导致NK细胞杀伤力不受肿瘤细胞上高唾液酸化聚糖影响。
该成果直接结合了目前有效的过继细胞治疗,发展的方法和化学工具有很强的转化医学价值,有望在未来抗击肿瘤中发挥一定功用。课题组陈红民、高涛和庄若璇同学参与了该研究;天津医科大学于辰华博士为此项工作做出了重要贡献。在此,特别感谢天然药物与仿生药物国家重点实验室光学成像仪器平台对该研究工作的支撑。(来源:科学网)
相关论文信息:DOI:10.1021/acscentsci.1c00064