2021年12月9日,北京大学化学与分子工程学院、北大-清华 联合中心雷晓光实验室与美国UCLA化学系KenN.Houk实验室合作,在Nature Catalysis杂志在线发表了题为“Enzymatic control ofendo- andexo-stereoselective Diels-Alder reactions with broad substrate scope”的研究论文,报道了自然界中催化不同endo/exo选择性Diels-Alder反应的酶,利用这两类酶实现了一些列D-A产物的高效精准合成,并解析了这两类不同endo/exo选择性D-A反应酶的催化机制,为后续D-A反应酶的开发和在药物合成上的工业化应用奠定了基础。
药物中间体、农药和精细化学品在国计民生中占据重要地位。传统的化学合成工艺存在效率低和污染严重等瓶颈问题;基于酶催化的生物合成工艺,具有过程绿色、选择性好等优势,目前特别在创新药物工业化生产中得到了广泛的应用。然而,目前酶催化反应的工具箱还非常有限,能够催化新颖化学转化的酶亟待被发现,从而推动酶催化在工业上更为广泛的应用,有助于实现化学品的“碳中和”生物绿色制造。
狄尔斯-阿尔德反应(Diels-Alder reaction,简称D-A反应)是共轭双烯(二烯体)与取代烯烃(亲二烯体)之间发生的[4+2]环加成反应,是合成化学中构建C-C键最常用的方法之一,已经在天然产物全合成,药物分子工业化生产以及材料化学等方面得到了广泛的应用。2021年诺贝尔化学奖授予的有机小分子催化所应用的第一个实例即为不对称D-A反应。为了实现某一个非对映异构体的高效合成,D-A反应过程中的区域、endo/exo以及对映立体选择性必须得到精准控制(图1a)。传统化学催化的D-A反应存在着立体选择性差,合成效率低等问题,因此从自然界中挖掘和利用立体专一性的D-A反应酶受到了化学家们的广泛关注和研究(Jeon, B. S., Wang, S.-A., Ruszczycky, M. W., Liu, H. W. Natural [4+2]-cyclases.Chem. Rev.2017, 117, 5367)。虽然目前已有一些高立体选择性D-A反应酶的报道,但它们一般催化的是分子内D-A反应,且往往仅能产生单一的endo构型产物,而合成应用价值更高的exo选择性的分子间D-A反应酶非常少见,极大限制了D-A反应酶在化学合成中的应用。
雷晓光实验室与KenN.Houk实验室合作,报道了自然界中催化不同endo/exo选择性Diels-Alder反应的酶,利用这两类酶实现了一些列D-A产物的高效精准合成,并解析了这两类不同endo/exo选择性D-A反应酶的催化机制,为后续D-A反应酶的开发和在药物合成上的工业化应用奠定了基础。
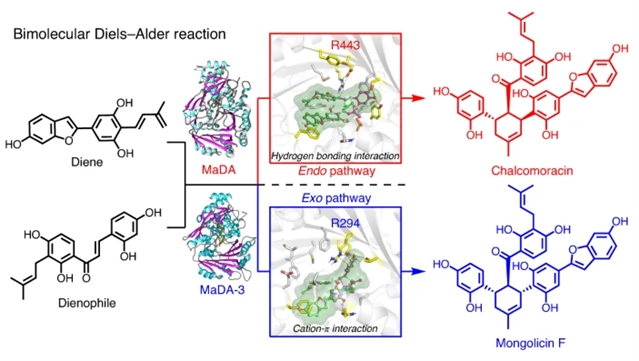
受到桑科植物中D-A类型天然产物生物合成的启发,作者从白桑中挖掘和鉴定到两类FAD依赖蛋白,其中一类FAD依赖蛋白(MaDA-1)具有与已知endo选择性D-A反应酶MaDA相同的功能,而另一类FAD依赖蛋白(MaDA-2和MaDA-3)催化了罕见的exo选择性的分子间D-A反应。作者还系统性探索了这两种选择性分子间D-A反应酶的底物适用范围,并利用它们实现了一系列天然和非天然D-A产物的高效精准合成,如图1所示。
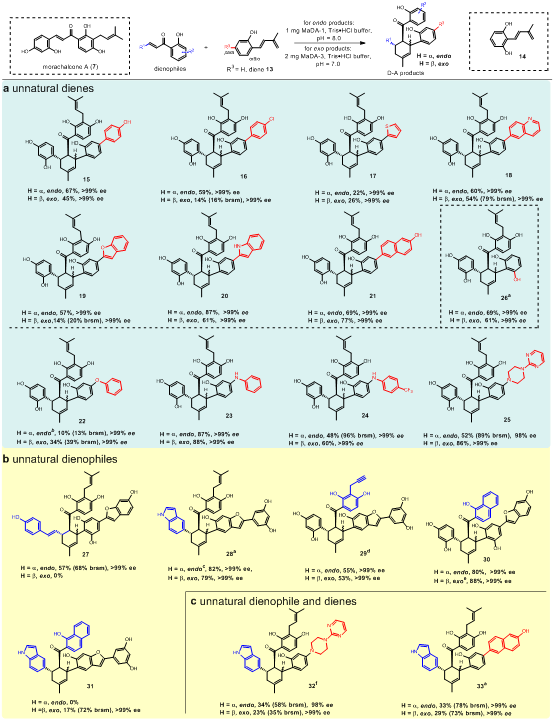
图1:D-A产物的高效精准酶法合成
作者还成功解析了exo选择性D-A反应酶MaDA-3的晶体结构,并结合计算模拟以及突变实验解析了这两类D-A反应酶具有不同endo/exo选择性的机制。作者发现endo选择性D-A反应酶MaDA可以稳定结合endo过渡态而不能稳定结合exo过渡态(图2c);而exo选择性D-A反应酶可以稳定结合exo过渡态而不能结合endo过渡态(图2f)。当endo过渡态与MaDA结合时,R443可以与亲二烯体形成较强氢键相互作用,从而促进了反应的发生(图2a);而在MaDA-3中R294可以与亲二烯体形成较强的cation-π相互作用,从而促进了反应的发生(图2d)。
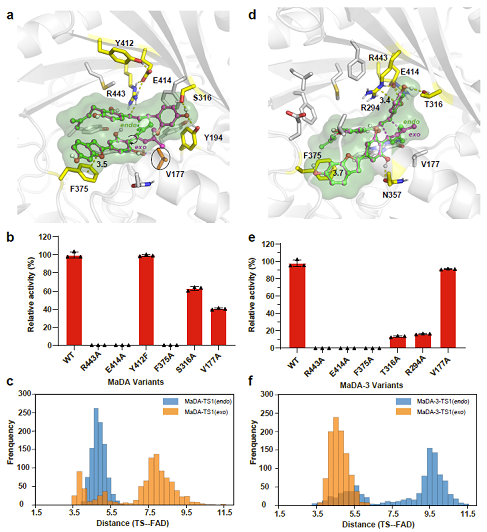
图2:不同endo/exo选择性D-A反应酶的机制研究
综上所述,北京大学雷晓光课题组与UCLA的K. N. Houk课题组合作报道了两种不同功能的FAD依赖蛋白,它们催化了不同endo/exo选择性D-A反应的发生,并证实了这类D-A反应酶具有良好的底物适用性以及立体选择性,在D-A产物的精准高效合成上具有重要的价值。此外,基于结构生物学,计算化学以及突变实验,他们还解析了不同选择性D-A反应酶的催化机制,证明了endo类型D-A反应酶主要是通过R443与亲二烯体形成氢键来促进D-A反应的发生;而exo类型D-A反应酶主要通过R294与亲二烯体形成cation-π相互作用来促进反应的发生。
在该工作中,雷晓光课题组特聘副研究员高磊博士,K. N. Houk课题组博士后邹一可博士,雷晓光课题组博士后刘小晶博士和博士研究生杨军为共同第一作者。雷晓光教授以及加州大学洛杉矶分校的K. N. Houk教授为共同通讯作者。雷晓光课题组特聘副研究员范俊萍博士以及博士后杜晓霞博士在晶体结构解析方面做出了重要贡献。雷晓光课题组的博士研究生王进、于欣水也在底物合成以及基因扩增方面提供了帮助。K. N. Houk课题组的Jiang Mingxuan以及Li Yuli也在DFT calculation上提供了帮助。该工作得到国家自然科学基金,国家科技部重点研究发展计划,北京市“卓越青年科学家计划”,北京分子科学国家研究中心,北大-清华 联合中心等多个国家重大科研项目和研究机构的资助。同时也特别感谢瑞士诺华制药公司对雷晓光课题组酶催化研究的资助与深入科研合作。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41929-021-00717-8