南方医科大学南方医院放疗科教授吴德华、副主任医师董忠谊团队首次研究揭示放-免联合治疗激活“远隔效应”的新靶点,并提出靶向性激活“远隔效应”以提高放-免联合治疗疗效的新策略,有望改变晚期癌症治疗理念与策略。3月13日,相关成果在线发表于《癌细胞》(Cancer Cell)。
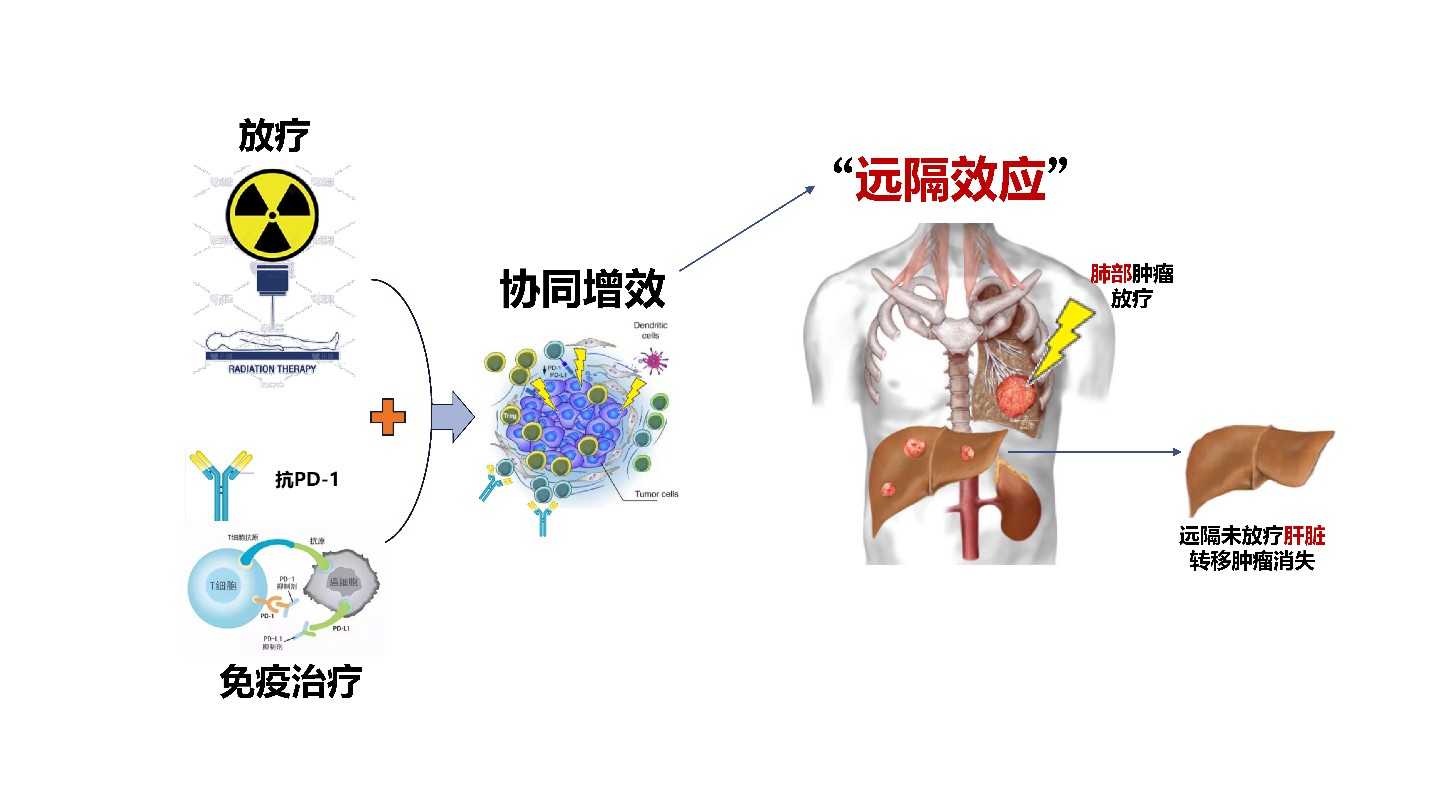 放-免联合治疗诱导“远隔效应”模式图。研究团队供图
放-免联合治疗诱导“远隔效应”模式图。研究团队供图
?
放疗联合免疫治疗以其独特的协同效应和突破性疗效,为抗癌战场注入强劲动力。放疗如同一把精准的“狙击枪”,不仅能直接摧毁肿瘤细胞,还能唤醒沉睡的免疫微环境,为免疫治疗铺平道路。而免疫治疗通过解除免疫抑制或增强免疫活性,调动人体自身的免疫大军,对肿瘤发起全面攻击。两者强强联合,形成“精准打击+全面围剿”的立体化攻势,实现“1+1>2”的协同效应,为肿瘤患者点燃了新的希望之火。
更令人振奋的是,这种联合治疗模式还能引发一种神奇的“远隔效应”——在对局部肿瘤进行放疗后,不仅照射区域的肿瘤得到控制,未接受照射的远处转移病灶也出现缩小甚至消退,犹如“隔山打牛”一样,为晚期患者注入了“强心剂”,显著提升了生存期望。
论文第一作者、南方医科大学2016级八年制学生张艳培表示,尽管“远隔效应”有利于抗肿瘤治疗,然而遗憾的是,临床中“远隔效应”的发生率却只有10%左右,而阻碍“远隔效应”的机制目前仍未阐述清楚。
针对上述临床挑战,南方医科大学南方医院放疗科团队围绕“放疗联合免疫治疗如何通过激活‘远隔效应’以实现协同增效作用”展开研究。他们首先从体内构建了“远隔效应”的动物模型,随后通过体内全基因组CRISPR文库筛选出阻碍“远隔效应”形成的关键靶点SFRP2及靶细胞SFRP2high CAFs。
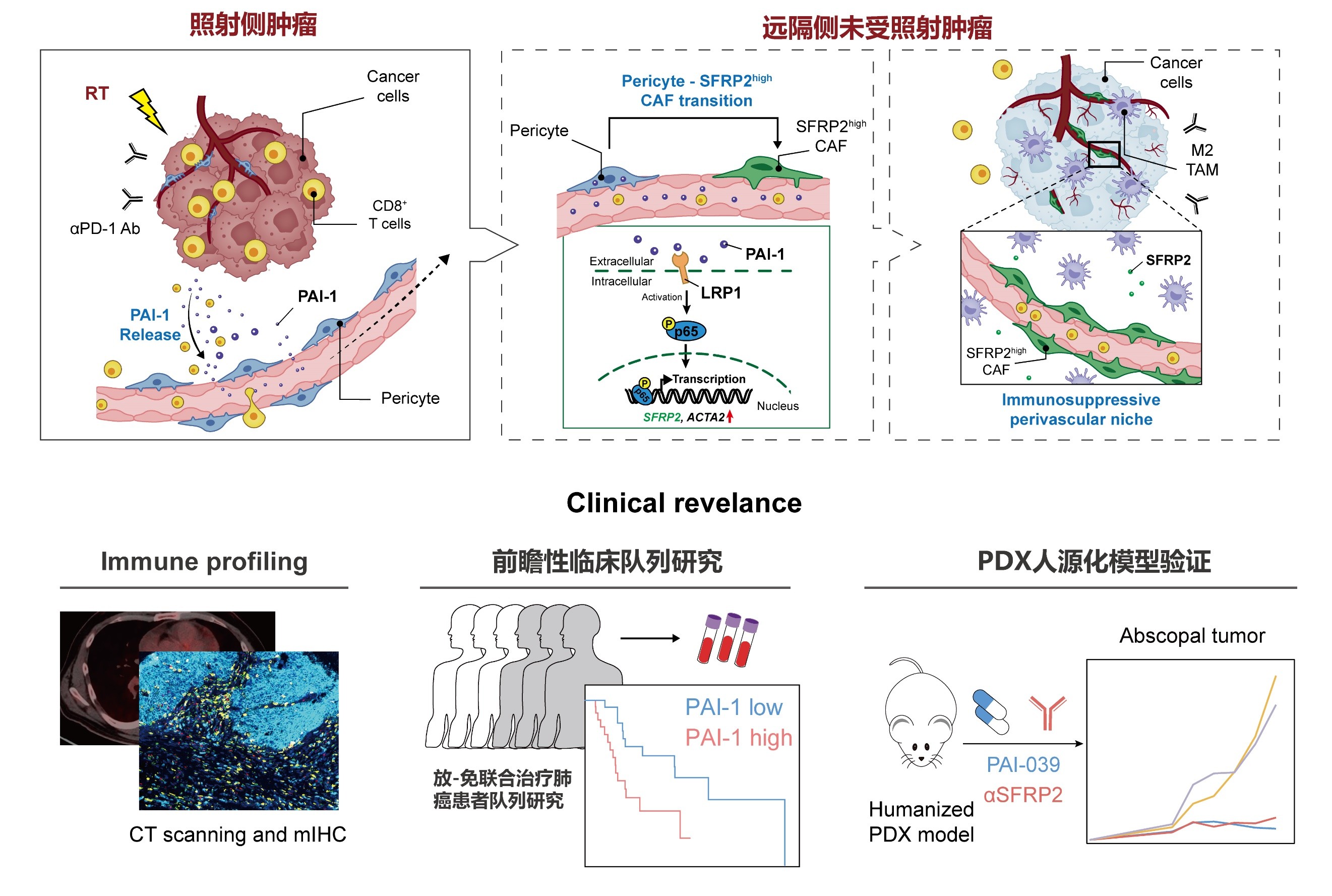 “远隔效应”分子机制及临床前研究。研究团队供图
“远隔效应”分子机制及临床前研究。研究团队供图
?
在分子机制层面,他们发现放-免联合治疗可以促进照射侧肿瘤产生分泌蛋白PAI-1,并释放入血,随后PAI-1到达远隔侧未放疗肿瘤,并与血管周细胞上的LRP1受体结合,进而促进血管周细胞向SFRP2high CAFs发生表型转化,而这群特殊的CAFs可以通过形成“围血管免疫抑制生态位”,从而阻碍“远隔效应”的形成。在临床转化层面,研究团队提供构建了PDX人源化模型,通过使用PAI-1抑制剂及SFRP2单克隆抗体进行干预处理,均可以有效改善“远隔效应”的发生,进而显著提高放-免联合治疗疗效。
“放疗在传统观念上是局部治疗产生局部效应,而‘远隔效应’的出现则可能改变游戏规则。对于晚期转移性肿瘤,放-免联合治疗,在远隔效应的加持下,局部治疗也可以产生全身效应,从而达到控制全身肿瘤的效果。”论文最后通讯作者董忠谊表示。
该研究的发布有望改变放疗在晚期转移性恶性肿瘤治疗中的价值和定位,未来需要开展前瞻性多中心临床研究以进一步验证上述理论。值得一提的是,研究发现的“远隔效应新靶点”已获一项国家发明专利授权,未来将进一步探讨如何实现临床转化。
相关论文信息:https://doi.org/10.1016/j.ccell.2025.02.024
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。