中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)研究员竺淑佳团队,系统揭示了镁离子(Mg2+)在N-甲基-D-天冬氨酸(NMDA)受体中的多重作用机制,诠释了Mg2+阻断和钙离子(Ca2+)通透的差异性分子机制,为理解NMDA受体在兴奋性突触传递中的功能及其在突触可塑性中的作用提供了新的视角。2月25日,相关研究发表于《神经元》。
Mg2+是神经系统中一种重要的二价阳离子,广泛参与神经发育、突触可塑性以及体内稳态的维持,其最为人熟知的功能之一是作为NMDA受体的电压依赖性阻断剂。然而,Mg2+在NMDA受体中的具体结合位点及其调控机制,Mg2+表现为阻断作用而Ca2+通透的结构基础,一直未得到全面解析。
研究团队记录表达在爪蟾卵母细胞上NMDA受体的电流-电压特性曲线后发现,在负电压下,Mg2+对GluN1-N2A和GluN1-N2B这两种NMDA受体亚型的阻断作用具有相似的亲和力;在正电压下,则仅对GluN1-N2B受体的外向电流表现出显著性的增强作用。这一结果表明,在去极化膜电位下,Mg2+显著增强了NMDA受体介导的外向电流。
进一步地,研究团队鉴定出了GluN1-N2B的3个Mg2+结合位点。位点I位于GluN1-N2B受体的选择性过滤器处,天冬酰胺环的侧链与Mg2+形成配位键,介导了电压依赖性阻断效应。位点II和位点III位于GluN2B亚基的N端结构域上的不同口袋,其中位点II由3个酸性残基组成,当这些残基同时突变时,GluN2B特异性Mg2+增强作用完全消失;位点III与锌离子(Zn2+)结合口袋重叠,参与了变构抑制作用,突变时将进一步提高Mg2+的增强作用。
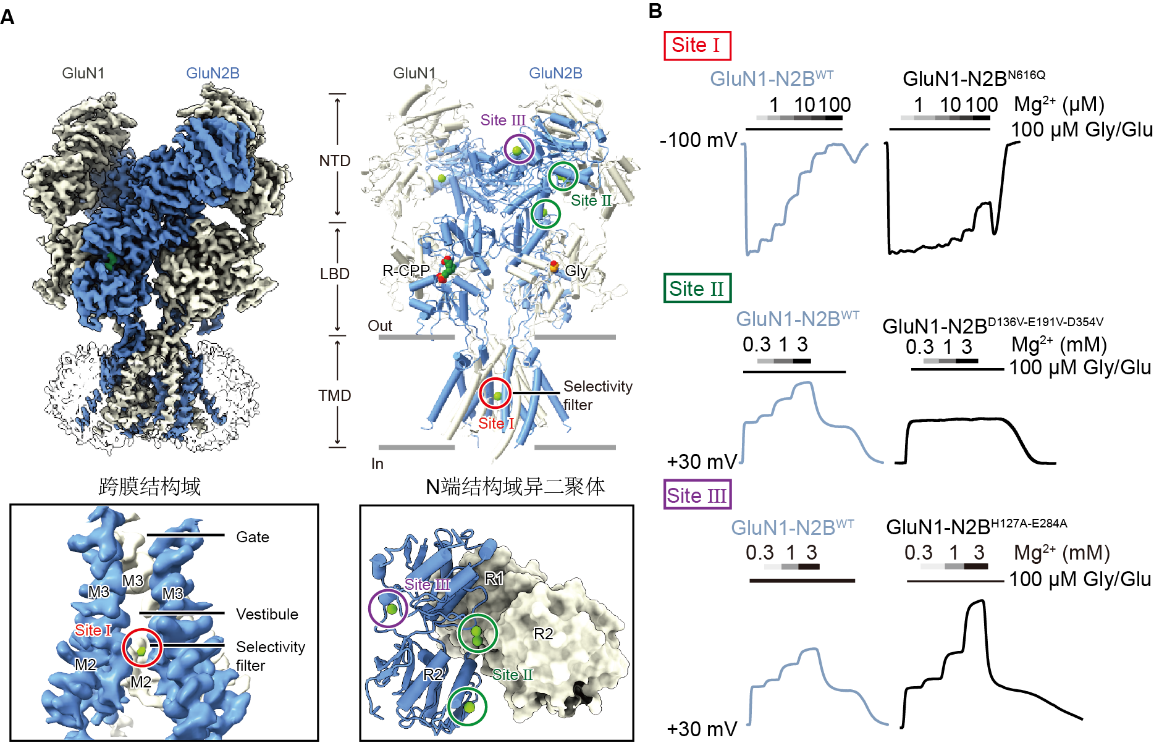 Mg
2+调控NMDA受体门控的分子机制。图片由研究团队提供
Mg
2+调控NMDA受体门控的分子机制。图片由研究团队提供
?
分子动力学模拟结果则揭示了Mg2+和Ca2+与NMDA受体残基相互作用的差异。Mg2+与天冬酰胺残基形成稳定的相互作用,而Ca2+主要与水分子形成配位键,无法像Mg2+一样在天冬酰胺环形成的空间内紧密结合,为NMDA受体中对Mg2+阻断和Ca2+通透的选择性差异提供了新的认识。
相关论文信息:https://doi.org/10.1016/j.neuron.2025.01.021
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。