|
|
| 聚糖分子调控帕金森病致病蛋白聚集 |
| 并抑制其病理毒性 |
中国科学院上海有机化学研究所研究员刘聪、俞飚合作,发现了肝素多糖对病理性淀粉样蛋白聚集的时序重塑能力,并阐释了其在疾病中的作用。这项工作开辟了运用寡糖活性分子调控病理蛋白聚集及病理毒性的新方向,为靶向蛋白病理聚集的神经退行性疾病药物设计提供了新分子和新思路。日前,相关成果发表于《自然-结构与分子生物学》。
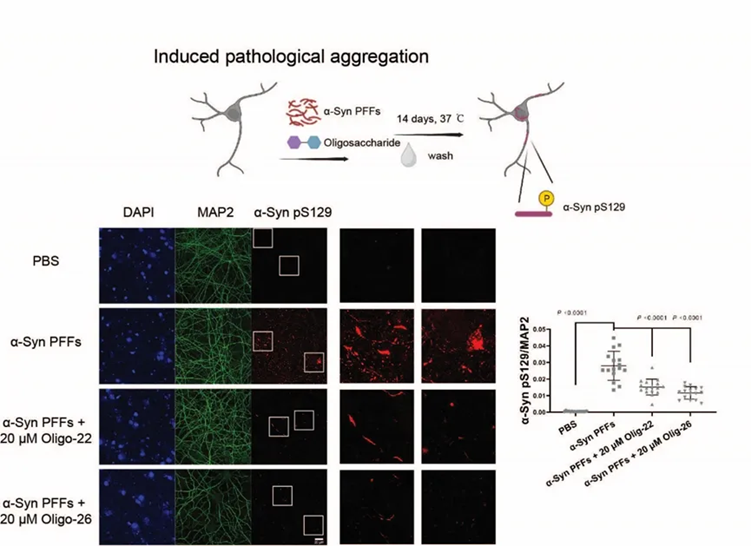 寡糖活性分子抑制α-syn在神经元中的病理性扩增
寡糖活性分子抑制α-syn在神经元中的病理性扩增
?
在阿尔兹海默病和帕金森病等神经退行性疾病中,致病淀粉样蛋白通过液-固相变聚集形成病理淀粉样纤维聚集体,是疾病的核心病理标志和重要诊疗靶点。此前研究揭示了细胞内多种生物活性分子对病理蛋白聚集具有动态调控作用,但对糖类分子是否以及如何调控蛋白病理性聚集的研究相对匮乏。
成熟的病理蛋白纤维聚集体由于存在大量分子间氢键和疏水相互作用被普遍认为具有超稳定的刚性结构。
然而,在本工作中,研究人员发现将成熟的α-syn纤维聚集体与肝素多糖孵育后,纤维的结构会随着时间的推移而发生演变。种种现象表明,肝素多糖具有重塑淀粉样纤维结构的能力。
研究人员还发现肝素多糖能与成熟的Tau纤维结合,并引发纤维螺旋的压缩。Tau纤维是阿尔兹海默病的关键病理聚集体。因此,肝素多糖具有重塑多种不同病理聚集体的能力,并可能通过识别及重塑蛋白病理聚集体来调控其与细胞膜的结合、内吞,以及胞内病理性扩增。
研究人员进一步寻找能够阻断肝素多糖与α-syn纤维结合的糖类分子。他们建立了肝素类寡糖库,并通过高通量竞争筛选实验,筛选出两种能够竞争肝素多糖的寡糖活性分子,这两种分子可有效抑制病理纤维聚集体的形成,并阻断其与神经元细胞膜的结合及在神经元细胞间的病理性传播,具备先导药物分子研发的潜力。
相关论文信息:
https://doi.org/10.1038/s41594-024-01407-2
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。