2023年4月3日,中科院生物物理研究所蔡华清课题组在Journal of Cell Biology杂志发表题为"GxcM-Fbp17/RacC-WASP signaling regulates polarized cortex assembly in migrating cells via Arp2/3"的研究论文,该论文描绘了运动细胞后端皮层微丝网络组装的信号通路,并揭示了Arp2/3介导的分枝状微丝在细胞中的新功能。
细胞皮层(cell cortex)是位于质膜下方的骨架网络,由微丝骨架、肌球蛋白及多种调控蛋白组成。皮层提供刚性以维持细胞形态,赋予细胞抵御外界机械力作用的能力;又具有高度可塑性,赋予细胞改变自身形态的能力,进而实现多种生物学功能。细胞中的微丝骨架包括成核因子Arp2/3复合体介导形成的分枝状微丝和依赖于Formin家族蛋白的束状微丝,二者均被报道参与细胞皮层的构建。然而,调控这些微丝在皮层组装的上游信号尚不明确。此外,在高度极化的细胞例如快速迁移的细胞中,皮层微丝网络如何实现在细胞前后端的不对称分布并执行不同的调控功能,也是尚未被解决的关键问题。
蔡华清课题组前期以盘基网柄菌(Dictyostelium discoideum)细胞为模型,系统筛选在细胞中极性定位的PH结构域蛋白,结果发现含有经典RhoGEF结构域(DH-PH结构域)的蛋白GxcM特异定位于定向迁移细胞的后端。过表达GxcM在细胞后端诱导大量微丝结构的产生,且该结构可被Arp2/3复合物标记,提示GxcM具备在细胞后端促进分枝状微丝组装的能力。

图1. GxcM定位在迁移细胞后端,促进Arp2/3复合体介导的分枝状微丝的组装。
通过构建一系列截短体和突变体,研究人员证明GxcM的功能执行依赖其C端富含脯氨酸的基序及其GEF活性。一方面,免疫共沉淀、质谱分析和显微成像实验显示,GxcM通过C端结合并招募F-BAR蛋白Fbp17。在fbp17敲除细胞中,GxcM仍然定位在细胞后端,却失去了促进微丝组装的能力,导致皮层微丝含量降低,细胞抵御外界机械力能力显著下降,且伴随细胞分裂和迁移的缺陷。生化和体外微丝聚合实验证明,Fbp17通过其SH3结构域结合并激活微丝促成核因子WASP,进而激活Arp2/3复合体,介导分枝状微丝组装。另一方面,研究发现GxcM还通过调节小G蛋白RacC的活性调控细胞后端微丝网络的组装。酵母双杂交和生化实验显示,活化形式的RacC结合Fbp17和WASP。在细胞中诱导表达持续活化形式的RacC,能够产生与GxcM过表达类似的效应,且该效应依赖Fbp17和WASP。敲除racC则引起与敲除fbp17类似的表型,不仅抑制GxcM的过表达效应,还引起皮层完整性和细胞功能的缺陷。
综上所述,该项研究描绘了促皮层微丝组装的新信号通路,由GxcM、RacC、Fbp17和WASP构成的信号通路在细胞后端激活Arp2/3复合体,促进分枝状微丝网络的构建。该研究拓展了对Arp2/3介导的分枝状微丝功能的认识。除了在运动细胞前端参与伪足形成这一被广泛研究的功能,该研究发现分枝状微丝在细胞后端参与皮层组装,维持皮层完整性,进而保证细胞迁移、分裂及胞饮功能正常进行的新功能。结合课题组之前的研究,这些工作解析了不同信号通路调控下分枝状微丝网络差异化作用的分子机制,为深入理解细胞极性和动态结构的建成机制奠定了重要基础。
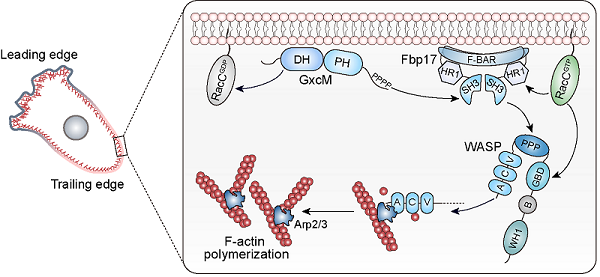
图2. GxcM、RacC、Fbp17和WASP构成的信号通路在细胞后端通过激活Arp2/3复合体,调控皮层分枝状微丝网络的构建,维持皮层结构完整性。
中科院生物物理研究所、中国科学技术大学联合培养博士生李栋和中科院生物物理研究所副研究员杨艺红为本文的并列第一作者,蔡华清研究员为本文的通讯作者。该研究得到清华大学李博、黄善金课题组和中科院生物物理研究所高璞、娄继忠课题组的大力协助,以及国家自然科学基金委、科技部和中科院先导项目等的经费支持。
文章链接:https://doi.org/10.1083/jcb.202208151
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。