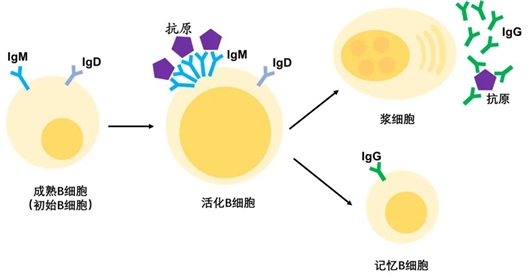
B细胞的“生命周期”概略示意图 施一公团队供图
8月19日,西湖大学施一公团队在《科学》上发表了题为《人源IgM B细胞受体的冷冻电镜结构》的研究论文。该论文首次报道了人源IgM同种型B细胞受体(IgM-BCR)的高分辨率三维结构,揭示了膜结合的IgM(mIgM)与Igα和Igβ异源二聚体复合物组装的分子机制,从而回答了B细胞受体如何组装这一重要科学问题,同时也为基于B细胞受体的免疫疗法提供了关键的结构基础。
B细胞也叫B淋巴细胞, 是适应性免疫系统的重要组成部分。它在抗原刺激下可分化为浆细胞和记忆B细胞:浆细胞可合成和分泌抗体,是人体的免疫屏障之一;记忆B细胞则可以“记录”下感染信息,并在体内长期存在,以备不时之需。
B细胞需要抗原与B细胞受体(BCR)的结合,才能进行增殖和分化,产生浆细胞和记忆细胞。这就好比,如果B细胞要组织一场免疫战斗,入侵的抗原是敌人,B细胞受体(BCR)则是探知敌人虚实的先锋。
早在1990年,德国马普所的Michael Reth实验室就鉴定发表了BCR的组分,在之后的三十多年中,人们对BCR胞外区如何识别各种抗原并激活B细胞信号通路进行了深入的研究。BCR由膜结合的免疫球蛋白(mIg)和Igα/Igβ异二聚体组成。其中mIg负责与抗原结合,Igα/Igβ参与信号传递。抗原结合以后,BCR在细胞膜表面寡聚化,Igα和Igβ被Lyn激酶磷酸化,之后激活下游信号通路。 BCR被认为是治疗B细胞恶性肿瘤的重要治疗靶点。例如,Polatuzumab vedotin是一种抗体偶联药物,该药物可以结合BCR中的Igβ组分,释放偶联的毒素分子,对B淋巴瘤细胞进行精准杀伤。尽管BCR十分重要,但科学家一直未能看清其结构。一旦获知BCR的结构信息,对于理解B细胞活化以及针对该复合物进行抗体药物的开发,将具有很高的潜在价值。
BCR根据mIg类型的不同,可以分为五种类型,即IgM、IgD、IgG、IgA和IgE。此次施一公团队的研究对象,正是其中的IgM型。实验过程中,他们首先将IgM-BCR的四个组分的cDNA进行密码子优化并克隆到表达载体上,接着通过共表达内质网潴留蛋白pERp1促进IgM二硫键的形成,帮助其正确折叠。之后,在蛋白纯化时加入抗体偶联药物Polatuzumab的Fab片段,最后通过冷冻电镜解析了第一个人源IgM同种型B细胞受体复合物3.3 埃(1埃等于0.1纳米)的高分辨率结构。
该IgM-BCR复合物结构包含一个mIgM和一个Igα/Igβ,它们以 1:1 的化学计量比非共价结合。在Igβ的上方,观察到了Polatuzumab的Fab片段的电子密度,证实了Polatuzumab结合在Igβ氨基末端的柔性区域。
在IgM-BCR的胞外区域,重链的胞外域与 Igα/Igβ的胞外域紧密堆叠。在近膜区域,两条重链中的一条通过连接肽(linker)穿过由 Igα/Igβ包围的中空结构。在跨膜区域,mIgM和Igα/Igβ的跨膜螺旋(TM)形成一个四螺旋束,通过跨膜螺旋之间的氢键来稳定构象。
这样的结构特征暗示了mIgM和Igα/Igβ在细胞内通过共折叠的方式形成复合物。施一公团队通过体外pull-down和体内免疫共沉淀(co-IP)实验, 验证了IgM-BCR的组分通过共折叠的方式在细胞内形成复合物的猜想,同时揭示了TM和linker在复合物组装中的重要作用。 除此之外,该结构揭示了胞外域上的 14 个糖基化位点,并发现三个潜在的表面抗体结合位点,可能有助于用于疾病干预的治疗性抗体或微型蛋白质的理性设计。和已经批准的抗体偶联药物Polatuzumab vedotin一样,这些特异性结合IgM-BCR的抗体或微型蛋白质,具有治疗B细胞淋巴瘤的潜力。
《科学》的审稿人对该项研究给予了高度评价:“这是B细胞生物学的一大突破,也是一项非常了不起的成就。”
相关论文信息:https://www.science.org/doi/10.1126/science.abo3923
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。