|
|
|
|
|
脂肪竟是乳腺癌“帮凶” |
|
科学家揭示三阴性乳腺癌逃避细胞死亡的新机制 |
乳腺癌预后较好,然而,其中约15%的三阴性乳腺癌因恶性程度较高,转移复发风险大,缺乏相应靶点,治疗效果差而被称为“最毒”乳腺癌。
复旦大学附属肿瘤医院教授胡夕春、王碧芸、陈光亮团队研究发现,与肿瘤周围脂肪细胞共培养的乳腺癌细胞,显示出对铁死亡的抵抗。进一步实验证实,脂肪细胞可以通过分泌特定的脂肪酸诱导乳腺癌细胞产生铁死亡抵抗,并且该过程依赖于脂肪酸合成酶ACSL3。研究团队通过动物模型,首次验证了脂肪细胞对三阴性乳腺癌的铁死亡保护。相关成果近日在线发表于《血液和肿瘤学杂志》。
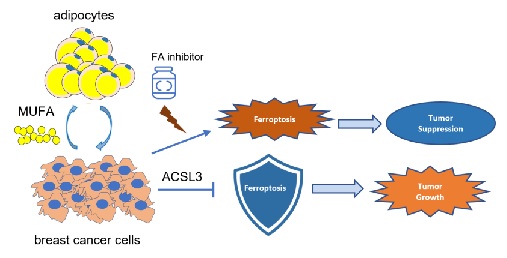
脂肪细胞对三阴性乳腺癌铁死亡保护的机制示意 受访者供图
“铁死亡是新发现的程序性细胞死亡方式,三阴性乳腺癌更具侵袭性及治疗耐受性的重要原因之一,是对各类细胞死亡的逃避。”胡夕春告诉《中国科学报》,“然而,此前还没有三阴性乳腺癌逃避铁死亡的研究报道。”
乳腺处于大量脂肪细胞浸润的独特微环境中,而先前有研究表明,脂肪细胞可以调控乳腺癌的脂肪酸代谢,并增强乳腺癌的侵袭转移能力,而铁死亡与脂肪酸代谢密切相关,因此研究者提出假设,脂肪细胞是否参与调控乳腺癌的铁死亡?
研究团队随后构建了乳腺癌—脂肪细胞共培养体系,并使用不同的铁死亡诱导剂,检测乳腺癌的铁死亡水平。结果证实,共培养脂肪细胞对铁死亡显著抵抗,且可被铁死亡抑制剂所逆转,而不能被凋亡等其他细胞死亡抑制剂所逆转。
同时,研究人员从蛋白表达、电镜、细胞增殖等多个角度验证了这一结果。
通过对共培养和单独培养细胞进行脂质组学分析,研究者发现共培养细胞中磷脂合成通路显著升高,后续使用外源性脂肪酸及脂肪酸摄取抑制剂等方法,探索并找到脂肪细胞通过分泌脂肪酸MUFA,调控乳腺癌细胞铁死亡。后续进行的ACSL3敲减实验证实,脂肪细胞和外源性MUFA对乳腺癌铁死亡的调控依赖于ACSL3。
“该研究首次发现脂肪细胞在调控三阴性乳腺癌铁死亡中的关键作用,并揭示了其作用机制,完善了学界对乳腺癌微环境和铁死亡关系的认识,并提供了潜在治疗靶点。”胡夕春说,“未来有望通过药物联合方式诱导三阴性乳腺癌铁死亡,从而实现治疗目的。”
相关论文信息:https://doi.org/10.1186/s13045-022-01297-1
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。